Isotope sind Varianten eines Atoms, die sich in der Anzahl der Neutronen im Atomkern unterscheiden. Diese Unterschiede können zu unterschiedlichen Massenzahlen führen und damit die chemischen Eigenschaften des Elements beeinflussen. Isotope ermöglichen es uns, wichtige Informationen über die geologische Vergangenheit, biologische Prozesse oder sogar medizinische Diagnosen zu gewinnen. Erfahren Sie mehr über die faszinierende Welt der Isotope und ihre Bedeutung in verschiedenen wissenschaftlichen Bereichen.
- Vogelfutterhaus: Einfache Anleitung zum Selbstbau
- Ab wann kann eine genähte Wunde ohne Pflaster versorgt werden?
- Wann kommt Scream 6 raus? Spannender neuer Teil des Slasher-Franchise
- Wann ist eine Papaya reif? Die besten Tipps für den richtigen Zeitpunkt
- Wann können Sie als Jahrgang 1959 in Rente gehen?
1. Isotope: Definition und Bedeutung in der Chemie
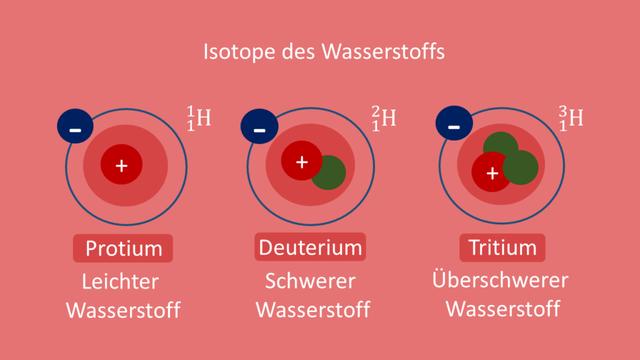
1.1 Definition von Isotopen
Isotope sind Nuklide, deren Atomkerne eine gleiche Anzahl Protonen (gleiche Ordnungszahl) aufweisen, aber eine unterschiedliche Anzahl von Neutronen enthalten. Dies führt zu ungleichen Massenzahlen, jedoch haben die Isotope desselben Elements weitgehend identisches chemisches Verhalten. Der Name „Isotop“ stammt aus dem Griechischen und bedeutet „gleicher Ort“, da Isotope eines bestimmten Elements im Periodensystem am gleichen Ort stehen.
1.2 Bedeutung von Isotopen in der Chemie
Die Unterscheidung von Isotopen ist von großer Bedeutung in der Chemie. Durch die verschiedenen Massenzahlen der Isotope können beispielsweise unterschiedliche Molekülstrukturen und Reaktionswege entstehen. Zudem ermöglichen isotopenmarkierte Verbindungen die Verfolgung chemischer Prozesse und die Bestimmung von Reaktionsmechanismen.
In der Natur kommen meist ein oder wenige stabile Isotope für jedes Element vor, während die übrigen Isotope radioaktiv und somit instabil sind. Diese radioaktiven Isotope zerfallen im Laufe der Zeit. Es gibt jedoch auch Elemente, bei denen alle ihre Isotope instabil sind.
In der Geothermie spielen instabile Isotope eine entscheidende Rolle, da etwa zwei Drittel der in der Erdkruste gespeicherten Energie vom Zerfall dieser radioaktiven Isotope stammt. Die Verteilung dieser Isotope in der Erdkruste ist sehr komplex und variiert von Standort zu Standort. Daher muss die Wärmeproduktion durch den Zerfall radioaktiver Isotope an jedem Ort separat betrachtet werden.
Bitte senden Sie Änderungs- oder Ergänzungswünsche an [email protected].
2. Die Rolle von Isotopen in der Geothermie
Isotopenverteilung in der Erdkruste
Die Verteilung radioaktiver Isotope in der Erdkruste spielt eine entscheidende Rolle für die Geothermie. Etwa zwei Drittel der in der Erdkruste gespeicherten Energie stammen vom Zerfall dieser Isotope. Da diese Verteilung sehr komplex ist, muss die hierdurch bedingte Wärmeproduktion an jedem Standort separat betrachtet werden.
Stabile und instabile Isotope
In der Regel besitzt jedes natürlich vorkommende Element ein oder wenige stabile Isotope, während seine übrigen Isotope radioaktiv und somit instabil sind. Diese instabilen Isotope zerfallen früher oder später. Es gibt jedoch auch Elemente, bei denen alle Isotope instabil sind.
Bedeutung für die Geothermie
Die Kenntnis über die Verteilung und Eigenschaften der verschiedenen Isotope ist für die Geothermie von großer Bedeutung. Sie ermöglicht es, geothermische Ressourcen besser zu verstehen und zu nutzen. Durch den Abbau der in Gesteinen vorhandenen instabilen Isotope kann Wärmeenergie gewonnen werden, die zur Strom- oder Wärmeerzeugung genutzt werden kann. Die Erforschung und Nutzung von isotopischen Daten trägt somit zur nachhaltigen Energieversorgung bei und unterstützt den Ausbau erneuerbarer Energien.
3. Isotope: Unterschiede in Masse und chemischem Verhalten erklärt
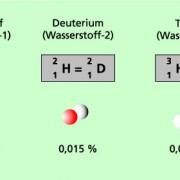
1. Unterschiede in Masse
Isotope sind Nuklide, deren Atomkerne eine gleiche Anzahl von Protonen, also die gleiche Ordnungszahl, aber unterschiedliche Anzahl von Neutronen haben. Dies führt zu ungleichen Massenzahlen der Isotope desselben Elements. Die Massenzahl ergibt sich aus der Summe von Protonen und Neutronen im Kern eines Atoms. Durch die Variation der Neutronenzahl entstehen verschiedene Isotope desselben Elements mit unterschiedlichen Massenzahlen.
2. Unterschiede im chemischen Verhalten
Trotz ihrer unterschiedlichen Massenzahlen zeigen Isotope desselben Elements ein weitgehend identisches chemisches Verhalten. Das liegt daran, dass das chemische Verhalten eines Elements hauptsächlich durch die Anzahl der Elektronen bestimmt wird, während die Anzahl der Protonen und Neutronen im Kern keine direkte Auswirkung auf das chemische Verhalten hat.
Isotope desselben Elements haben dieselbe Anzahl an Elektronen und somit ähnliche elektronische Strukturen. Dadurch verhalten sie sich chemisch ähnlich und zeigen beispielsweise ähnliche Reaktionsmuster oder Bindungseigenschaften.
Insgesamt ermöglichen uns die Isotope eines Elements eine genauere Untersuchung seiner Eigenschaften und Verhaltensweisen in verschiedenen Bereichen wie Chemie, Physik oder Geologie.
4. Frederick Soddy und die Entdeckung der Isotope

4.1 Die Arbeit von Frederick Soddy
Frederick Soddy war ein britischer Chemiker, der im frühen 20. Jahrhundert wichtige Beiträge zur Erforschung der Radioaktivität und der Atomstruktur leistete. In seiner Arbeit untersuchte er verschiedene radioaktive Elemente und entdeckte dabei, dass sich ihre Atome in ihrer Masse voneinander unterschieden, obwohl sie die gleiche chemische Identität hatten. Er prägte den Begriff „Isotop“ für diese unterschiedlichen Formen desselben Elements.
4.2 Der Nobelpreis für Frederick Soddy
Für seine bahnbrechenden Arbeiten zu den Isotopen und radioaktiven Elementen erhielt Frederick Soddy im Jahr 1921 den Nobelpreis für Chemie. Seine Entdeckungen revolutionierten das Verständnis von Atomstrukturen und legten den Grundstein für weitere Forschungen auf diesem Gebiet.
4.3 Die Bedeutung der Isotope in der Geothermie
In der Geothermie, also der Nutzung von Erdwärme zur Energiegewinnung, spielen die Isotope eine entscheidende Rolle. Viele Gesteine enthalten instabile Isotope, die im Laufe der Zeit zerfallen und dabei Wärme freisetzen. Etwa zwei Drittel der in der Erdkruste gespeicherten Energie stammen aus diesem Zerfallprozess. Aufgrund der komplexen Verteilung dieser radioaktiven Isotope ist es wichtig, die Wärmeproduktion an jedem Standort individuell zu betrachten und zu analysieren. Dieses Wissen ist essentiell für die effiziente Nutzung der Geothermie als erneuerbare Energiequelle.
5. Natürliche vs. radioaktive Isotope: Eine Übersicht
Natürliche Isotope:
– Natürlich vorkommende Elemente besitzen in der Regel ein oder wenige stabile Isotope.
– Diese stabilen Isotope haben eine gleichbleibende Anzahl an Protonen und Neutronen in ihren Atomkernen.
– Aufgrund ihrer Stabilität zeigen sie ein weitgehend identisches chemisches Verhalten.
– Die Verteilung dieser natürlichen Isotope in der Erdkruste ist komplex und variiert von Standort zu Standort.
Radioaktive Isotope:
– Einige Elemente besitzen ausschließlich instabile, also radioaktive, Isotope.
– Radioaktive Isotope haben eine unterschiedliche Anzahl an Neutronen im Vergleich zu den stabilen Isotopen desselben Elements.
– Diese instabilen Isotope zerfallen im Laufe der Zeit und geben dabei Energie ab.
– Etwa zwei Drittel der in der Erdkruste gespeicherten Energie stammen vom Zerfall dieser radioaktiven Isotope.
– Die Verteilung der radioaktiven Isotope in der Erdkruste ist ebenfalls sehr komplex und muss bei geothermischen Untersuchungen berücksichtigt werden.
6. Die Wärmeproduktion durch instabile Isotope in der Erdkruste
1. Die Bedeutung instabiler Isotope
Instabile Isotope spielen eine entscheidende Rolle in Bezug auf die Wärmeproduktion in der Erdkruste. Etwa zwei Drittel der gespeicherten Energie in der Erdkruste stammen vom Zerfall dieser radioaktiven Isotope. Diese Isotope sind charakterisiert durch eine unterschiedliche Anzahl von Neutronen im Atomkern im Vergleich zu den stabilen Isotopen desselben Elements. Obwohl sie instabil sind und früher oder später zerfallen, haben sie ein weitgehend identisches chemisches Verhalten wie ihre stabilen Gegenstücke.
2. Komplexität der Verteilung radioaktiver Isotope
Die Verteilung radioaktiver Isotope in der Erdkruste ist äußerst komplex. Daher muss die hierdurch bedingte Wärmeproduktion an jedem Standort separat betrachtet werden. Jedes natürlich vorkommende Element besitzt ein oder wenige stabile Isotope, während die übrigen Isotope radioaktiv und somit instabil sind. Dies bedeutet, dass nicht alle Elemente gleichmäßig zur Wärmeproduktion beitragen. Die genaue Zusammensetzung und Konzentration der radioaktiven Isotope variiert von Region zu Region.
3. Bedeutung für die Geothermie
Die Kenntnis über die Verteilung und Konzentration der instabilen Isotope in der Erdkruste ist von großer Bedeutung für die Geothermie. Da die Wärmeproduktion durch den Zerfall dieser Isotope erfolgt, kann sie zur Nutzung von geothermischer Energie genutzt werden. Die in Gesteinen vorhandenen instabilen Isotope tragen etwa zwei Drittel zur gespeicherten Energie in der Erdkruste bei. Daher sind Untersuchungen und Analysen der radioaktiven Isotope unerlässlich, um das Potenzial geothermischer Ressourcen an bestimmten Standorten zu bestimmen und effizient zu nutzen.
Diese Informationen wurden zuletzt im Januar 2020 bearbeitet. Bei Änderungs- oder Ergänzungswünschen können Sie sich gerne an [email protected] wenden.
Zusammenfassend sind Isotope Varianten eines Elements mit unterschiedlicher Anzahl von Neutronen im Kern. Sie spielen eine wichtige Rolle in der Atomphysik, Medizin und Archäologie. Ihre Eigenschaften ermöglichen es uns, die Struktur und Veränderungen von Materialien und Organismen zu untersuchen. Durch Isotopenanalysen können wir historische Ereignisse rekonstruieren und medizinische Diagnosen verbessern. Das Wissen über Isotope hilft uns, die Welt um uns herum besser zu verstehen und neue Entdeckungen zu machen.

