Eine exotherme Reaktion ist ein chemischer Prozess, bei dem Energie in Form von Wärme freigesetzt wird. Dabei handelt es sich um eine wichtige Eigenschaft vieler chemischer Reaktionen, die in unserem Alltag vorkommen. In diesem Artikel werden wir näher auf das Konzept der exothermen Reaktion eingehen und ihre Bedeutung für die Chemie erklären.
- Selbstgemachtes Gewürzöl – Tipps und Tricks für die perfekte Zubereitung
- Dürfen Hunde Gummibärchen essen? – Ein Hunde-Profi klärt auf!
- Ab wann blitzt ein Blitzer? Die wichtigsten Fakten zur Geschwindigkeitsmessung
- Wann Kortison einnehmen: Dosierung und Anwendungstipps
- Der Zölibat für katholische Priester – Seit wann besteht diese Verpflichtung?
Grundlagen und Merkmale einer exothermen Reaktion
Eine exotherme Reaktion ist eine chemische Reaktion, bei der Energie in Form von Wärme, Licht oder Schall freigesetzt wird und an die Umgebung abgegeben wird. Diese Art von Reaktionen zeichnet sich durch bestimmte Merkmale aus.
Freisetzung von Energie:
Eine exotherme Reaktion gibt Wärmeenergie oder Lichtenergie ab. Dies bedeutet, dass die Edukte (Ausgangsstoffe) eine höhere Energie haben als die Produkte nach der Reaktion. Die überschüssige Energie wird an die Umgebung abgegeben.
Temperaturerhöhung:
Eine exotherme Reaktion führt oft zu einer Erhöhung der Umgebungstemperatur, da Wärmeenergie freigesetzt wird. Dies kann beispielsweise durch das Entstehen von Flammen oder einer erhöhten Temperatur des Reaktionsgemisches erkennbar sein.
Spontane Reaktion:
Viele exotherme Reaktionen laufen spontan ab, da sie keine zusätzliche Energiezufuhr benötigen, außer der Aktivierungsenergie. Sobald diese überwunden ist, setzt die Reaktion von selbst ein.
Potenzial für Explosionen:
Aufgrund der großen Menge an freigesetzter Energie besteht bei exothermen Reaktionen ein hohes Potenzial für Explosionen oder andere gefährliche Vorgänge. Daher müssen entsprechende Sicherheitsvorkehrungen getroffen werden.
Es ist wichtig zu beachten, dass eine exotherme Reaktion eine negative Enthalpieänderung aufweist. Dies bedeutet, dass die Reaktionsenthalpie (die Gesamtenergie der Produkte) geringer ist als die der Edukte. Der Energieverlauf einer exothermen Reaktion kann in einem Energiediagramm dargestellt werden, das oft als „Energieberg“ bezeichnet wird.
Ein Beispiel für eine exotherme Reaktion ist die Verbrennung von Holz. Hierbei reagiert das Holz mit Sauerstoff aus der Luft und setzt dabei Kohlenstoffdioxid, Wasser und Wärmeenergie frei. Diese freigesetzte Energie kann zum Heizen genutzt oder in andere Energieformen umgewandelt werden.
Exotherme Reaktionen stehen im Gegensatz zu endothermen Reaktionen, bei denen Energie hinzugefügt werden muss, um die Reaktion stattfinden zu lassen.
Energieabgabe bei chemischen Reaktionen: Was ist eine exotherme Reaktion?
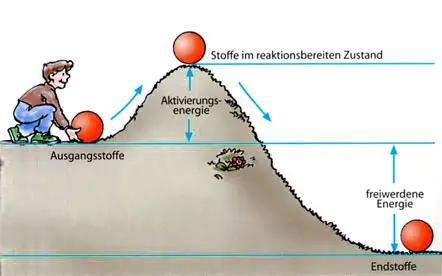
Eine exotherme Reaktion ist eine chemische Reaktion, bei der Energie in Form von Wärme, Licht oder Schall freigesetzt wird und an die Umgebung abgegeben wird. Dies bedeutet, dass der Ausgangsstoff der Reaktion Energie gespeichert hat und diese während der Reaktion an die Umgebung abgibt. Exotherme Reaktionen sind oft durch eine erhöhte Temperatur, Flammenbildung oder Explosionen erkennbar.
Es gibt verschiedene Merkmale, die auf eine exotherme Reaktion hinweisen können. Eine solche Reaktion zeichnet sich durch die Freisetzung von Energie aus, entweder in Form von Wärmeenergie oder Lichtenergie. Dadurch kann es zu einer Erhöhung der Temperatur in der Umgebung kommen. Viele exotherme Reaktionen laufen spontan ab, da keine weitere Energie außer der Aktivierungsenergie zugeführt werden muss. Aufgrund der großen Menge an freigesetzter Energie besteht ein hohes Potenzial für Explosionen und andere gefährliche Reaktionen.
Die Enthalpieänderung einer exothermen Reaktion ist immer negativ. Das bedeutet, dass die Gesamtenergie der Produkte geringer ist als die der Ausgangsstoffe. Eine exotherme Reaktion beginnt mit den Ausgangsstoffen (Edukten), die miteinander reagieren und eine Verbindung bilden. Da das Energieniveau der Ausgangsstoffe nicht ausreicht, um die Reaktion zu starten, muss Aktivierungsenergie hinzugefügt werden. Diese bricht chemische Bindungen auf und bringt die Reaktionspartner in einen instabilen Zustand. Während der Reaktion wird Energie freigesetzt und an die Umgebung abgegeben, wodurch die Produkte ein niedrigeres Energieniveau als die Ausgangsstoffe haben.
Ein Beispiel für eine exotherme Reaktion ist die Verbrennung von Holz. Dabei reagiert das Holz mit Sauerstoff aus der Luft und setzt Kohlenstoffdioxid, Wasser und Wärmeenergie frei. Die freigesetzte Wärmeenergie kann zum Heizen genutzt oder in andere Energieformen umgewandelt werden. Weitere Beispiele für exotherme Reaktionen sind die Bildung von Salzsäure aus Natriumchlorid und Salpetersäure oder die Reaktion von Natronlauge und Salzsäure zur Bildung von Kochsalz und Wasser.
Eine exotherme Reaktion steht im Gegensatz zu einer endothermen Reaktion, bei der Energie zugeführt werden muss. Die Unterschiede zwischen den beiden Reaktionstypen werden in unserem Video zum Thema exotherme und endotherme Reaktion erklärt.
Erkennungsmerkmale und Beispiele für exotherme Reaktionen
Erkennungsmerkmale einer exothermen Reaktion:
– Freisetzung von Energie: Eine exotherme Reaktion gibt Wärmeenergie oder Lichtenergie ab.
– Temperaturerhöhung: Eine exotherme Reaktion führt oft zu einer Erhöhung der Temperatur der Umgebung, da Wärmeenergie freigesetzt wird.
– Spontane Reaktion: Viele exotherme Reaktionen laufen spontan ab, da man ihnen, abgesehen von der Aktivierungsenergie, keine weitere Energie hinzufügen muss.
– Potenzial für Explosionen: Eine exotherme Reaktion setzt große Mengen an Energie frei. Deswegen besteht ein hohes Potenzial für Explosionen und andere gefährliche Reaktionen.
Beispiele für exotherme Reaktionen:
– Verbrennungsreaktionen: Die Verbrennung von Holz oder Gas sind Beispiele für exotherme Reaktionen. Dabei reagieren die Ausgangsstoffe mit Sauerstoff aus der Luft und setzen dabei Kohlenstoffdioxid, Wasser und Wärmeenergie frei.
– Oxidationsreaktionen: Die Reaktion von Eisen und Sauerstoff ist eine weitere exotherme Reaktion. Hierbei entsteht Rost und es wird ebenfalls Wärmeenergie freigesetzt.
– Bildung von Salzsäure aus Natriumchlorid und Salpetersäure oder die Reaktion von Natronlauge und Salzsäure zur Bildung von Kochsalz und Wasser sind weitere Beispiele für exotherme Reaktionen.
Es ist wichtig zu beachten, dass exotherme Reaktionen eine negative Enthalpieänderung aufweisen, da die Gesamtenergie der Produkte geringer ist als die der Edukte. Der Energieverlauf einer exothermen Reaktion kann in einem Energiediagramm dargestellt werden, welches als „Energieberg“ bezeichnet wird.
Exotherme Reaktionen: Energiefreisetzung und Temperaturerhöhung
Energiefreisetzung bei exothermen Reaktionen
Bei einer exothermen Reaktion wird Energie in Form von Wärme, Licht oder Schall freigesetzt. Dies bedeutet, dass die Ausgangsstoffe der Reaktion Energie gespeichert haben und diese während der Reaktion an die Umgebung abgeben. Die freigesetzte Energie kann zum Beispiel dazu genutzt werden, um andere Stoffe zu erwärmen oder um elektrische Energie zu erzeugen. Exotherme Reaktionen sind daher oft mit einer Erhöhung der Temperatur verbunden.
Temperaturerhöhung als Indikator für exotherme Reaktionen
Eine erhöhte Temperatur ist ein häufiges Anzeichen für eine exotherme Reaktion. Da bei dieser Art von Reaktion Wärmeenergie freigesetzt wird, führt dies oft zu einer Erwärmung der Umgebung. Dies kann beispielsweise durch eine Flammenbildung oder eine spürbare Wärmezunahme bemerkbar sein. Eine erhöhte Temperatur kann auch auf eine chemische Explosion hinweisen, da große Mengen an Energie freigesetzt werden.
Merkmal einer spontanen Reaktion
Viele exotherme Reaktionen laufen spontan ab, das heißt sie finden ohne zusätzliche Energiezufuhr statt. Abgesehen von der Aktivierungsenergie, die benötigt wird, um die chemische Bindungen aufzubrechen und die Reaktionspartner in einen instabilen Zustand zu bringen, wird keine weitere Energie benötigt. Dies macht exotherme Reaktionen oft sehr schnell und effizient.
Potenzial für Explosionen
Aufgrund der großen Menge an freigesetzter Energie besteht bei exothermen Reaktionen ein hohes Potenzial für Explosionen und andere gefährliche Reaktionen. Die hohe Energiemenge kann dazu führen, dass sich die Reaktion unkontrolliert ausbreitet und Schäden verursacht. Daher ist es wichtig, exotherme Reaktionen unter kontrollierten Bedingungen durchzuführen und entsprechende Sicherheitsvorkehrungen zu treffen.
Zusammenfassend sind exotherme Reaktionen chemische Reaktionen, bei denen Energie freigesetzt wird. Diese Energiefreisetzung kann in Form von Wärme, Licht oder Schall erfolgen und führt oft zu einer Erhöhung der Temperatur der Umgebung. Exotherme Reaktionen können spontan ablaufen und haben ein hohes Potenzial für Explosionen.
Exotherme Reaktionen: Definition, Eigenschaften und Beispiele
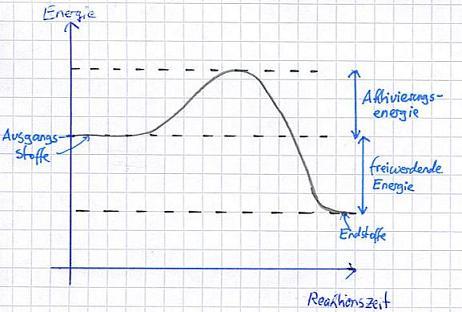
Definition
Exotherme Reaktionen sind chemische Reaktionen, bei denen Energie in Form von Wärme, Licht oder Schall freigesetzt und an die Umgebung abgegeben wird. Während dieser Reaktionen steigt der Energielevel der Ausgangsstoffe an, da weitere Energie zugeführt wird.
Eigenschaften
– Freisetzung von Energie: Eine exotherme Reaktion gibt Wärmeenergie oder Lichtenergie ab.
– Temperaturerhöhung: Eine exotherme Reaktion führt oft zu einer Erhöhung der Temperatur der Umgebung, da Wärmeenergie freigesetzt wird.
– Spontane Reaktion: Viele exotherme Reaktionen laufen spontan ab, da ihnen außer der Aktivierungsenergie keine weitere Energie hinzugefügt werden muss.
– Potenzial für Explosionen: Eine exotherme Reaktion setzt große Mengen an Energie frei, wodurch ein hohes Potenzial für Explosionen und andere gefährliche Reaktionen besteht.
Beispiele
– Verbrennung von fossilen oder erneuerbaren Brennstoffen
– Kombination von Wasserstoff und Sauerstoff zur Bildung von Wasser
– Verbrennung von Holz
– Oxidationsreaktion zwischen Eisen und Sauerstoff
Diese Beispiele verdeutlichen, wie bei exothermen Reaktionen Energie freigesetzt wird und wie sie sich in Form von Wärme oder Licht manifestiert.
Exotherme Reaktionen: Energieabgabe an die Umgebung
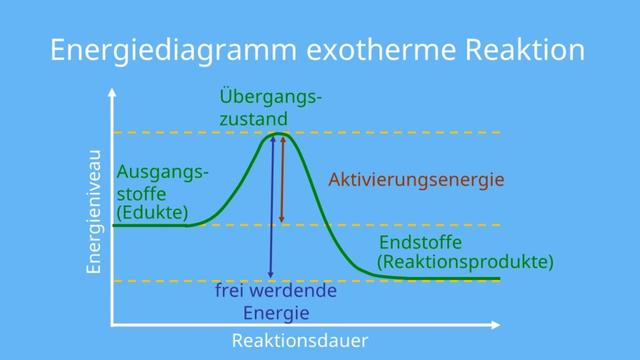
Was sind exotherme Reaktionen?
Exotherme Reaktionen sind chemische Reaktionen, bei denen Energie in Form von Wärme, Licht oder Schall freigesetzt wird und an die Umgebung abgegeben wird. Während dieser Reaktionen steigt der Energielevel der Ausgangsstoffe an, da weitere Energie zugeführt wird. Diese zusätzliche Energie ermöglicht es den Ausgangsstoffen, chemische Bindungen zu brechen und neue Verbindungen zu bilden.
Merkmale von exothermen Reaktionen
Es gibt verschiedene Merkmale, anhand derer man exotherme Reaktionen erkennen kann:
– Freisetzung von Energie: Eine exotherme Reaktion gibt Wärmeenergie oder Lichtenergie ab.
– Temperaturerhöhung: Eine exotherme Reaktion führt oft zu einer Erhöhung der Temperatur der Umgebung, da Wärmeenergie freigesetzt wird.
– Spontane Reaktion: Viele exotherme Reaktionen laufen spontan ab, da ihnen außer der Aktivierungsenergie keine weitere Energie zugeführt werden muss.
– Potenzial für Explosionen: Aufgrund der großen Menge an freigesetzter Energie besteht bei exothermen Reaktionen ein hohes Potenzial für Explosionen und andere gefährliche Situationen.
Beispiele für exotherme Reaktionen
Ein bekanntes Beispiel für eine exotherme Reaktion ist die Verbrennung von fossilen oder erneuerbaren Brennstoffen wie Holz oder Gas. Bei dieser Reaktion wird Energie in Form von Wärme freigesetzt. Weitere Beispiele sind die Kombination von Wasserstoff und Sauerstoff, bei der Wasser und viel Wärme entstehen, oder die Reaktion von Natronlauge und Salzsäure zur Bildung von Kochsalz und Wasser.
Insgesamt sind exotherme Reaktionen für viele alltägliche Vorgänge von großer Bedeutung, da sie Energie freisetzen, die wir nutzen können, um uns zu erwärmen oder andere Arbeiten zu verrichten.
Zusammenfassend kann gesagt werden, dass eine exotherme Reaktion eine chemische Reaktion ist, bei der Wärmeenergie an die Umgebung abgegeben wird. Diese Art von Reaktionen sind in vielen Bereichen des täglichen Lebens von großer Bedeutung und spielen eine wichtige Rolle in der Industrie, Medizin und Energieerzeugung. Durch das Verständnis und die Kontrolle exothermer Reaktionen können wir effizientere Prozesse entwickeln und nutzen.

