Ein Kation ist ein positiv geladenes Atom oder eine Gruppe von Atomen, das/eine die elektronische Bindung eingehen kann. Es entsteht, wenn ein Atom Elektronen verliert und dadurch seine Gesamtladung erhöht. Kationen spielen eine wichtige Rolle in chemischen Reaktionen und sind für viele physikalische Eigenschaften von Stoffen verantwortlich. Erfahren Sie mehr über die Bedeutung und Eigenschaften von Kationen in diesem Artikel.
- Das seltenste Sternzeichen enthüllt: Wassermann, Widder und Schütze.
- Gyros vom Spieß – Leckeres Rezept für selbstgemachtes Gyros
- Hurensohn: Jugendwort oder Schimpfwort – Was bedeutet es?
- Ereignisse, Geburtstage und Todestage am 6. Juni 2022: Deutsche U21-Nationalmannschaft wird Fußball-Europameister
- Die Gefahren beim Befahren dieser Straße: Informiere dich jetzt über das Führerschein-bestehen.de Lernsystem!
Die Bedeutung von Kationen in der Chemie
Kationen spielen eine wichtige Rolle in der Chemie, insbesondere in der Elektrochemie. Sie sind positiv geladene Ionen, die entstehen, wenn ein Atom Elektronen abgibt. Diese Elektronenübertragung findet in Redoxreaktionen statt und ermöglicht den Transport von Ladungen durch Lösungen oder Schmelzen.
1. Elektrolyse: Kationen sind entscheidend für den Prozess der Elektrolyse. Bei der Elektrolyse werden Substanzen durch Anlegen einer elektrischen Spannung in ihre Bestandteile zerlegt. Dabei wandern die positiven Kationen zur negativen Elektrode (Kathode), wo sie Elektronen aufnehmen und zu neutralen Atomen oder Molekülen reduziert werden.
2. Salze: Kationen sind auch Bestandteile von Salzen, die aus einem positiven Kation und einem negativen Anion bestehen. In Salzlösungen dissoziieren die Salze in ihre Ionen und ermöglichen so den elektrischen Stromfluss.
3. Metalle: In metallischen Verbindungen bilden sich Kationen, da Metalle dazu neigen, ihre äußeren Elektronen abzugeben und somit positive Ladungen anzunehmen. Dies ermöglicht ihnen eine hohe elektrische Leitfähigkeit.
4. Ionenaustausch: In vielen chemischen Reaktionen spielt der Austausch von Kationen eine wichtige Rolle. Durch den Austausch von Kationen können verschiedene Stoffe selektiv gebunden oder freigesetzt werden.
5. Katalyse: Manche Kationen wirken als Katalysatoren, indem sie die Reaktionsgeschwindigkeit chemischer Reaktionen erhöhen. Sie können dabei als Zwischenstufen fungieren und den Reaktionsweg erleichtern.
Die Bedeutung von Kationen in der Chemie ist also vielfältig und reicht von elektrochemischen Prozessen über die Bildung von Salzen bis hin zur Beeinflussung chemischer Reaktionen. Durch das Verständnis der Eigenschaften und des Verhaltens von Kationen können wir viele chemische Phänomene besser verstehen und gezielt nutzen.
Was sind Kationen und wie entstehen sie?
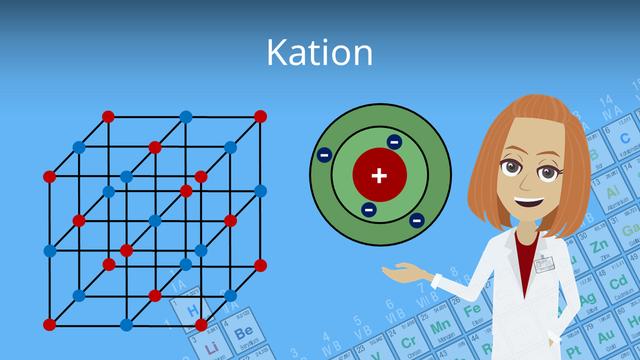
Ein Kation ist ein positiv geladenes Ion, das entsteht, wenn ein Atom Elektronen abgibt. Ein Atom besteht aus einem Atomkern, der Protonen und Neutronen enthält, sowie einer Atomhülle mit Elektronen. Im elementaren Zustand ist das Atom elektrisch neutral, da die Anzahl der Protonen gleich der Anzahl der Elektronen ist.
Wenn ein Atom jedoch Elektronen abgibt oder aufnimmt, entsteht ein Ungleichgewicht zwischen positiver und negativer Ladung. Wenn ein Atom mehr Protonen als Elektronen hat, entsteht ein Kation mit einer positiven Ladung. Die positive Ladung zieht negativ geladene Teilchen an und stößt andere positive Teilchen ab.
Kationen können durch Oxidation von Elementen oder Anionen entstehen. Bei einer Oxidationsreaktion gibt ein Atom Elektronen ab und wird zum Kation. Bei einer Reduktionsreaktion nimmt ein Atom Elektronen auf und wird zum Anion.
Das Standardelektrodenpotential eines Atoms gibt an, wie stark es dazu neigt, Elektronen abzugeben. Je niedriger das Standardelektrodenpotential ist, desto leichter wird das Atom zum Kation.
Metallkationen sind besonders wichtig in der chemischen Industrie, da sie zur Gewinnung von Metallen verwendet werden. Metalle haben viele technische Anwendungen und spielen eine wichtige Rolle in verschiedenen Bereichen.
Zusammenfassend kann man sagen, dass Kationen positiv geladene Ionen sind, die entstehen, wenn ein Atom Elektronen abgibt. Sie spielen eine wichtige Rolle in der Chemie und haben verschiedene Anwendungen in der Industrie.
Die chemische Zusammensetzung von Kationen
Ein Kation ist ein positiv geladenes Ion, das entsteht, wenn ein Atom Elektronen abgibt. Die Ladung des Kations wird als hochgestellte Zahl angegeben und zeigt die Anzahl der fehlenden Elektronen im Vergleich zu den Protonen im Atomkern an. Zum Beispiel ist Fe3+ ein dreifach positiv geladenes Eisenkation.
Kationen können aus einfachen oder zusammengesetzten Atomen bestehen. Einfache Kationen bestehen aus einem einzigen Atom, während zusammengesetzte Kationen aus mehreren Atomen bestehen. Metallkationen sind eine wichtige Gruppe von Kationen und umfassen Elemente der ersten, zweiten und dritten Hauptgruppe sowie einige Elemente aus den Nebengruppen des Periodensystems.
Die Anzahl der Elektronen, die ein Atom abgibt, hängt von der Verteilung der Elektronen auf den Schalen ab. Ziel ist es, die äußerste Schale vollständig zu besetzen. Die Anzahl der Elektronen pro Schale kann im Periodensystem abgelesen werden. Metalle haben oft weniger als acht Elektronen in ihrer äußeren Schale und geben daher lieber Elektronen ab, um eine stabile Edelgaskonfiguration zu erreichen.
Die chemische Industrie nutzt Metallkationen aufgrund ihrer Bedeutung bei der Gewinnung von Metallen. Metalle werden für verschiedene technische Anwendungen benötigt und spielen eine wichtige Rolle in verschiedenen Branchen wie dem Bauwesen oder der Elektronikindustrie.
Warum sind Kationen wichtig für den Lernerfolg in der Chemie?
1. Grundlagenverständnis
Um die Chemie zu verstehen, ist es wichtig, die Grundlagen des Atomaufbaus und der Ladungen zu kennen. Kationen spielen eine entscheidende Rolle bei der Bildung von Verbindungen und dem Verständnis chemischer Reaktionen. Durch das Verstehen von Kationen können Schülerinnen und Schüler besser nachvollziehen, wie sich Elemente verhalten und wie sie miteinander interagieren.
2. Reaktionsmechanismen
Kationen sind auch wichtig, um Reaktionsmechanismen zu verstehen. Viele chemische Reaktionen beinhalten die Bildung oder den Abbau von Kationen. Indem man das Verhalten von Kationen kennt, kann man Vorhersagen über mögliche Reaktionsschritte treffen und die Produkte einer Reaktion besser verstehen.
3. Anwendungen in der Industrie
Kationen haben auch praktische Anwendungen in der Industrie. Viele Metalle werden aus ihren entsprechenden Kationen gewonnen und finden dann Verwendung in verschiedenen technischen Anwendungen. Ein gutes Verständnis von Kationen ermöglicht es Schülerinnen und Schülern, diese industriellen Prozesse besser zu verstehen und ihre Bedeutung für unsere Gesellschaft zu erkennen.
Insgesamt sind Kationen ein wichtiger Bestandteil des Chemieunterrichts, da sie grundlegende Konzepte erklären, das Verständnis von chemischen Reaktionen verbessern und praktische Anwendungen in der Industrie haben. Ein solides Verständnis von Kationen ist daher entscheidend für den Lernerfolg in der Chemie.
Die Rolle von Kationen im Transport von Sauerstoff durch das Blut

Die Anziehungskraft zwischen Kationen und Sauerstoffmolekülen
Die roten Blutkörperchen im Blut enthalten Eisenkationen (Fe2+), die eine positive Ladung tragen. Das Sauerstoffmolekül (O2) hingegen besitzt freie Elektronenpaare und ist negativ geladen. Aufgrund der gegensätzlichen Ladungen werden die Sauerstoffmoleküle von den Eisenkationen angezogen und somit durch den Körper transportiert.
Entstehung von Kationen
Kationen entstehen, wenn ein Element oder ein Anion genug Elektronen abgibt, indem es diese auf andere Atome überträgt. Es findet also eine Elektronenübertragung statt, bei der ein Atom Elektronen abgibt (Oxidation) und ein anderes Atom diese Elektronen aufnimmt (Reduktion). Durch ausreichende Oxidation können Kationen entstehen, die weniger Elektronen als Protonen haben und somit positiv geladen sind.
Rolle der Metallkationen im Transportprozess
Metallkationen spielen eine wichtige Rolle beim Transport von Sauerstoff durch das Blut. Sie ermöglichen die Bindung der Sauerstoffmoleküle an die roten Blutkörperchen und sorgen so für den reibungslosen Transport zu den Organen. Die positiven Ladungen der Metallionen ziehen die negativ geladenen Sauerstoffmoleküle an und ermöglichen somit den Transport.
Beispiele für Kationen im Blut
Im Blut sind verschiedene Kationen vorhanden, die wichtige Funktionen erfüllen. Ein Beispiel ist das Natriumkation (Na+), das eine entscheidende Rolle bei der Regulation des Wasserhaushalts und des osmotischen Drucks spielt. Weitere Beispiele sind das Kaliumkation (K+) und das Calciumkation (Ca2+), die für die Erregungsleitung in Nervenzellen und Muskelzellen von großer Bedeutung sind.
Bedeutung von Kationen in anderen biologischen Prozessen
Neben dem Transport von Sauerstoff durch das Blut spielen Kationen auch in vielen anderen biologischen Prozessen eine wichtige Rolle. Sie sind beispielsweise an der Signalübertragung in Nervenzellen beteiligt, regulieren den pH-Wert im Körper und sind essentiell für enzymatische Reaktionen. Ohne Kationen wären viele lebenswichtige Prozesse im menschlichen Körper nicht möglich.
Zusammenfassung
Kationen spielen eine zentrale Rolle beim Transport von Sauerstoff durch das Blut. Durch ihre positive Ladung ziehen sie die negativ geladenen Sauerstoffmoleküle an und ermöglichen so deren Bindung an die roten Blutkörperchen. Neben dem Transport von Sauerstoff erfüllen Kationen auch in anderen biologischen Prozessen wichtige Funktionen und sind essentiell für den reibungslosen Ablauf verschiedener Stoffwechselvorgänge im Körper.
Alles, was du über Kationen wissen musst
Was sind Kationen?
Kationen sind positiv geladene Ionen, die entstehen, wenn ein Atom weniger Elektronen als Protonen besitzt. Ein Kation wird durch eine Elektronenübertragung gebildet, bei der das Atom Elektronen abgibt. Die Ladung des Kations wird als hochgestellte Zahl angegeben. Zum Beispiel ist Fe^3+ ein dreifach positiv geladenes Eisenkation.
Wie entstehen Kationen?
Kationen entstehen, wenn ein Element oder ein Anion genug Elektronen abgibt, um weniger Elektronen als Protonen zu haben. Eine Elektronenübertragung findet immer zwischen zwei Atomen statt: einem, das Elektronen abgibt (Oxidation) und einem anderen, das diese Elektronen aufnimmt (Reduktion). Durch diese Übertragung entsteht ein Kation.
Beispiele für Kationen
Es gibt einfache Kationen, die aus nur einem Atom bestehen, und zusammengesetzte Kationen, die aus mehreren Atomen bestehen. Beispiele für einfache Kationen sind Na^+ (Natrium), Mg^2+ (Magnesium) und Al^3+ (Aluminium). Zusammengesetzte Kationen können verschiedene Wertigkeiten haben und werden oft in der organischen Chemie verwendet.
Die Bedeutung von Metallkationen
Metallkationen spielen eine wichtige Rolle in der chemischen Industrie, da aus ihnen die notwendigen Metalle gewonnen werden können. Metalle haben verschiedene Anwendungen in Technik und Alltag, wie zum Beispiel in der Elektronik, im Bauwesen und in der Medizin.
Das Coulombsche Gesetz
Die Wechselwirkung zwischen Kationen und anderen geladenen Teilchen wird durch das Coulombsche Gesetz beschrieben. Dieses Gesetz besagt, dass sich geladene Teilchen mit unterschiedlichen Ladungen anziehen und Teilchen mit gleicher Ladung sich abstoßen. Die Stärke dieser Wechselwirkung hängt von der Ladung der Teilchen ab.
Das Standardelektrodenpotential
Das Standardelektrodenpotential ist ein Spannungswert, der angibt, wie willig ein Atom Elektronen abgibt. Je negativer das Elektrodenpotential ist, desto höher ist das Bestreben des Atoms, Elektronen abzugeben. Das Standardelektrodenpotential kann unter verschiedenen Bedingungen berechnet werden.
Die Verteilung der Elektronen auf Schalen
Die Anzahl der Elektronen auf den Schalen eines Atoms kann im Periodensystem abgelesen werden. Die äußerste Schale eines Atoms wird oft nicht vollständig besetzt. Einige Elemente geben lieber Elektronen ab, um eine vollständige äußere Schale zu erreichen (Oktettregel).
Diese Informationen sind wichtig, um das Verhalten von Kationen zu verstehen und ihre Rolle in chemischen Reaktionen nachvollziehen zu können.
Zusammenfassend kann gesagt werden, dass ein Kation ein positiv geladenes Ion ist, das durch den Verlust von Elektronen entsteht. Es spielt eine wichtige Rolle in chemischen Reaktionen und ist häufig in Salzen und Säuren zu finden. Die Kenntnis über Kationen ist für das Verständnis der Chemie und ihrer Anwendungen unerlässlich.

