Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronenübertragungen zwischen den beteiligten Teilchen stattfinden. Dabei werden Oxidations- und Reduktionsvorgänge gleichzeitig ablaufen. Diese Reaktionen spielen eine wichtige Rolle in der Chemie und sind fundamental für viele natürliche und industrielle Prozesse. In diesem Artikel werden wir uns genauer mit dem Konzept der Redoxreaktionen befassen und deren Bedeutung verstehen lernen.
- Das Alter von Julia Westlake: Eine Erfolgsgeschichte mit beeindruckenden Jahren
- Wie lange wird Krankengeld gezahlt?
- Frauke Ludowig: Moderatorin im Alter – Lebensfreude und Gelassenheit
- Erfrischungsgeld-Auszahlung in Berlin: Wann und wie viel erhalten Wahlhelfer?
- ROSSMANN Filialfinder: Öffnungszeiten und Standorte in Deutschland
Grundlagen und Erklärung: Was ist eine Redoxreaktion?
Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronen zwischen den beteiligten Stoffen übertragen werden. Dabei gibt ein Reaktionspartner Elektronen ab, während ein anderer Partner diese Elektronen aufnimmt. Diese Elektronenabgabe wird als Oxidation bezeichnet, während die Elektronenaufnahme als Reduktion bezeichnet wird. Eine Redoxreaktion besteht also aus zwei Teilreaktionen.
In einer Redoxreaktion können verschiedene Stoffe miteinander reagieren, wie zum Beispiel in Batterien, Akkumulatoren oder sogar in unserem Körper. Ein Beispiel für eine Redoxreaktion ist die Reaktion von Eisen(III)-oxid mit Aluminium, bei der Eisen und Aluminiumoxid entstehen.
Die Oxidation findet meistens exotherm statt, also unter Abgabe von Wärmeenergie. Wenn Oxidation und Reduktion räumlich voneinander getrennt sind, kann durch den Fluss von Elektronen Strom erzeugt werden. Dieses Prinzip wird in galvanischen Zellen angewendet.
Um eine Redoxgleichung aufzustellen, gibt es sieben Schritte zu beachten: Bestimmung der Oxidationszahlen der beteiligten Stoffe, Identifizierung der Teilreaktionen (Oxidation und Reduktion), Erstellung der Teilgleichungen mit den übertragenen Elektronen, Ladungsausgleich (je nach Medium), Stoffausgleich mit Wasser, Elektronenausgleich und schließlich die Addition und Kürzung der Teilgleichungen zur Gesamtgleichung.
Es ist wichtig zu beachten, dass nicht bei jeder Redoxgleichung alle Schritte durchgeführt werden müssen. Je nach Aufgabe können einige Schritte übersprungen werden. Es gibt jedoch ein einheitliches Vorgehen, mit dem man immer zum Ziel kommt.
Insgesamt sind Redoxreaktionen wichtige Prozesse in der Chemie und haben viele praktische Anwendungen. Sie spielen eine Rolle in Batterien, Akkumulatoren und anderen elektrochemischen Systemen. Durch das Verständnis von Redoxreaktionen können wir die Welt um uns herum besser verstehen und auch chemische Reaktionen selbst durchführen oder erklären.
Redoxgleichungen selbst aufstellen: Schritt-für-Schritt Anleitung
Eine Redoxgleichung besteht aus zwei Teilreaktionen, der Oxidation und der Reduktion. Hier ist eine Schritt-für-Schritt Anleitung, wie du eine Redoxgleichung selbst aufstellen kannst:
1. Bestimme die Oxidationszahlen der beteiligten Stoffe. Reine Elemente haben immer die Oxidationszahl 0, während Verbindungen insgesamt neutral sind.
2. Identifiziere die Teilreaktionen, indem du schaust, welche Stoffe oxidiert oder reduziert werden. Die Oxidation ist der Vorgang, bei dem ein Stoff Elektronen abgibt und seine Oxidationszahl erhöht wird. Die Reduktion ist der Vorgang, bei dem ein Stoff Elektronen aufnimmt und seine Oxidationszahl verringert wird.
3. Erstelle die Teilgleichungen für die Oxidation und die Reduktion. Gib an, wie viele Elektronen abgegeben bzw. aufgenommen werden. Die abgegebenen Elektronen stehen auf der rechten Seite der Teilgleichung, während die aufgenommenen Elektronen auf der linken Seite stehen.
4. Addiere beide Teilgleichungen und kürze sie gegebenenfalls, indem du gleiche Substanzen auf beiden Seiten eliminierst.
5. Überprüfe die Ladungsausgleichung in der Gesamtgleichung. Wenn nötig, füge Ionen hinzu (wie Hydroxid- oder Oxonium-Ionen) oder verwende Wasserstoffionen (H3O+) für den Ausgleich.
6. Gleiche die Anzahl der Atome auf beiden Seiten der Gesamtgleichung aus, indem du Wasser hinzufügst.
7. Stelle sicher, dass die Anzahl der übertragenen Elektronen in beiden Teilgleichungen gleich ist. Multipliziere bei Bedarf eine oder beide Teilgleichungen, um dies zu erreichen.
8. Schreibe die Gesamtgleichung auf und überprüfe sie auf Konsistenz und Ladungsausgleich.
Mit dieser Schritt-für-Schritt Anleitung kannst du Redoxgleichungen selbst aufstellen und verstehen, wie Elektronen in chemischen Reaktionen übertragen werden.
Bedeutung von Redoxreaktionen in Batterien, Akkumulatoren und im Körper
Redoxreaktionen spielen eine wichtige Rolle in Batterien, Akkumulatoren und sogar im menschlichen Körper. In diesen Systemen werden Elektronen übertragen, um Energie zu erzeugen oder chemische Prozesse zu ermöglichen.
In Batterien und Akkumulatoren findet eine Redoxreaktion statt, um elektrische Energie zu erzeugen. Dabei wird ein Stoff oxidiert und gibt Elektronen ab, während ein anderer Stoff reduziert wird und die Elektronen aufnimmt. Diese Elektronenübertragung ermöglicht den Fluss von elektrischem Strom.
Im menschlichen Körper finden ebenfalls viele Redoxreaktionen statt. Eine bekannte Redoxreaktion ist die Atmung. Dabei wird Sauerstoff (O2) reduziert, indem er Elektronen aufnimmt, während Kohlenstoffdioxid (CO2) oxidiert wird und Elektronen abgibt. Dieser Prozess ermöglicht die Energiegewinnung in unseren Zellen.
Auch der Stoffwechselprozess in unserem Körper beruht auf Redoxreaktionen. Hier werden Nährstoffe wie Kohlenhydrate, Fette und Proteine oxidiert, um Energie freizusetzen. Gleichzeitig werden dabei Elektronendonatoren wie NADH oder FADH2 reduziert.
Zusammenfassend kann man sagen, dass Redoxreaktionen in Batterien, Akkumulatoren und im Körper eine entscheidende Rolle bei der Erzeugung von Energie spielen. Sie ermöglichen den Fluss von elektrischem Strom und sind essentiell für viele Stoffwechselprozesse in unserem Körper.
Beispiel einer Redoxreaktion: Eisen(III)-oxid mit Aluminium
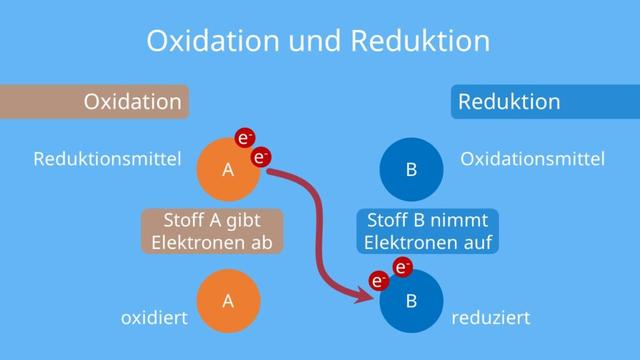
Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronen übertragen werden. Dabei gibt ein Reaktionspartner Elektronen ab, die ein anderer Partner aufnimmt. Die Elektronenabgabe wird Oxidation genannt, während die Elektronenaufnahme als Reduktion bezeichnet wird.
Eine Redoxreaktion besteht aus zwei Teilreaktionen: einer Oxidation und einer Reduktion. In der Oxidation gibt ein Stoff Elektronen ab und wird selbst oxidiert. Dieser Stoff wird als Reduktionsmittel bezeichnet. In der Reduktion nimmt ein anderer Stoff Elektronen auf und wird selbst reduziert. Dieser Stoff wird als Oxidationsmittel bezeichnet.
Die Oxidation findet meistens exotherm statt, also unter Abgabe von Wärmeenergie. Wenn Oxidation und Reduktion räumlich voneinander getrennt sind, kann durch den Elektronenfluss Strom erzeugt werden, wie es in Batterien oder Akkumulatoren geschieht.
Um eine Redoxgleichung aufzustellen, können sieben Schritte befolgt werden:
1. Bestimmung der Oxidationszahlen der beteiligten Stoffe.
2. Festlegung der Teilreaktionen (Oxidation und Reduktion) anhand der Veränderungen der Oxidationszahlen.
3. Erstellung der vollständigen Teilgleichungen für jede Teilreaktion unter Berücksichtigung des Elektronenflusses.
4. Ladungsausgleich durch Hinzufügen von Ionen oder Molekülen.
5. Stoffausgleich durch Hinzufügen von Wasser.
6. Elektronenausgleich durch Multiplikation einer Teilreaktion, um die Anzahl der übertragenen Elektronen auszugleichen.
7. Addition der Teilgleichungen und Kürzen der Gesamtgleichung.
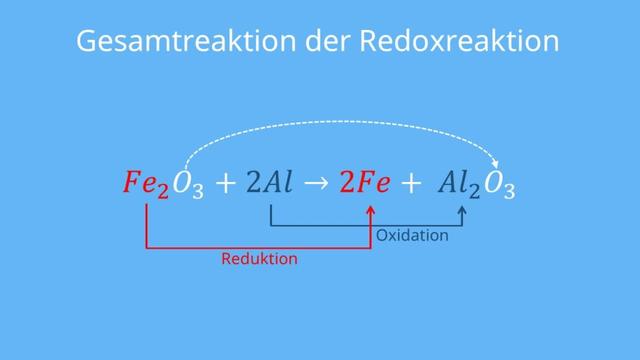
Ein Beispiel für eine Redoxreaktion ist die Reaktion von Eisen(III)-oxid mit Aluminium zu Eisen und Aluminiumoxid. Hierbei wird Eisen(III)-oxid oxidiert, indem es Sauerstoff an Aluminium abgibt. Gleichzeitig wird Aluminium reduziert, indem es den Sauerstoff aufnimmt.
Die Redoxreaktion kann in Teilreaktionen aufgeteilt werden:
Oxidation: 2 Fe2O3 -> 4 Fe + 3 O2
Reduktion: 2 Al -> 2 Al3+ + 6 e-
Durch Addition und Kürzen erhält man die Gesamtgleichung:
2 Fe2O3 + 2 Al -> 4 Fe + 3 O2 + 2 Al3+
In diesem Beispiel wird Eisen(III)-oxid als Reduktionsmittel bezeichnet, da es Elektronen abgibt und sich selbst oxidiert. Aluminium hingegen ist das Oxidationsmittel, da es Elektronen aufnimmt und sich selbst reduziert.
Diese Schritte können verwendet werden, um jede Redoxreaktion aufzustellen. Es ist jedoch wichtig zu beachten, dass nicht bei jeder Redoxgleichung alle Teilschritte durchgeführt werden müssen.
Aufstellung einer Redoxgleichung am Beispiel von Zink und Salzsäure

Aufstellung einer Redoxgleichung am Beispiel von Zink und Salzsäure:
Zuerst betrachten wir die Gesamtreaktion, bei der Zink mit Salzsäure zu Zinkchlorid und Wasserstoff reagiert.
Die Gesamtreaktion lautet:
Zn + 2HCl -> ZnCl2 + H2
Nun können wir mit den 7 Schritten die Redoxgleichung aufstellen:
1. Bestimmung der Oxidationszahlen:
– Die Oxidationszahl von elementarem Zink (Zn) ist 0.
– Die Oxidationszahl von Wasserstoff (H) in Salzsäure (HCl) ist +1.
– Die Oxidationszahl von Chlor (Cl) in Zinkchlorid (ZnCl2) ist -1.
2. Bestimmung der Teilreaktionen:
– Zink wird oxidiert, da seine Oxidationszahl von 0 auf +2 steigt.
– Wasserstoff wird reduziert, da seine Oxidationszahl von +1 auf 0 sinkt.
3. Erstellung der Teilgleichungen:
Oxidation: Zn -> Zn^2+ + 2e^-
Reduktion: 2H+ + 2e^- -> H2
4. Ladungsausgleich:
Da keine Angabe zur Reaktionsumgebung gemacht wurde, gehen wir vom Neutralen aus und verwenden Oxonium-Ionen (H3O+) für den Ladungsausgleich.
5. Stoffausgleich:
Da beide Teilgleichungen bereits ausgeglichen sind, entfällt dieser Schritt.
6. Elektronenausgleich:
Da beide Teilgleichungen bereits die gleiche Anzahl an Elektronen haben, entfällt dieser Schritt.
7. Zusammenführung der Teilgleichungen zur Gesamtgleichung:
Zn + 2HCl -> ZnCl2 + H2
Die Redoxgleichung für die Reaktion von Zink mit Salzsäure ist somit:
Zn + 2HCl -> ZnCl2 + H2
Aufstellung einer Redoxgleichung am Beispiel von Kupferoxid und Kohlenstoff
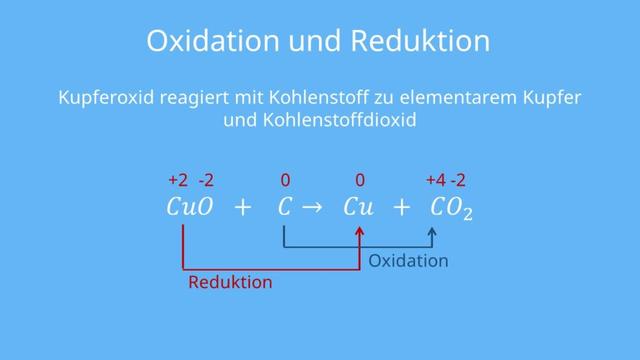
In diesem Beispiel betrachten wir die Reaktion zwischen Kupferoxid (CuO) und Kohlenstoff (C), bei der elementares Kupfer (Cu) und Kohlenstoffdioxid (CO2) entstehen.
1. Schritt: Bestimmung der Oxidationszahlen
– Sauerstoff hat fast immer die Oxidationszahl -2.
– Elementares Kupfer hat die Oxidationszahl 0.
– Kohlenstoffdioxid besteht aus einem Kohlenstoffatom, das die Oxidationszahl +4 haben muss, da zwei Sauerstoffatome mit je -2 vorhanden sind.
2. Schritt: Bestimmung der Teilreaktionen (Oxidation, Reduktion)
– Der Kohlenstoff wird oxidiert, da seine Oxidationszahl von 0 auf +4 steigt.
– Das Kupfer wird reduziert, da seine Oxidationszahl von +2 auf 0 sinkt.
3. Schritt: Aufstellen der Teilgleichungen mit den übertragenen Elektronen
Oxidation: C -> CO2
– Der Kohlenstoff gibt vier Elektronen ab.
Reduktion: CuO -> Cu
– Das Kupferoxid nimmt vier Elektronen auf.
4. Schritt: Ladungsausgleich
Da keine Angabe zur Reaktionsumgebung gemacht wurde, gehen wir vom Neutralen aus und verwenden Oxonium-Ionen (H3O+) für den Ladungsausgleich.
5. Schritt: Stoffausgleich
Da keine weiteren Stoffe vorhanden sind, fällt dieser Schritt weg.
6. Schritt: Elektronenausgleich
Da auf beiden Seiten der Teilgleichungen bereits die gleiche Anzahl an Elektronen vorhanden ist, fällt dieser Schritt ebenfalls weg.
7. Schritt: Zusammensetzen der Teilgleichungen zur Gesamtgleichung
Die Oxidations- und Reduktionsreaktion werden zu einer einzigen Gesamtgleichung kombiniert:
C + 2CuO -> CO2 + 2Cu
Damit haben wir erfolgreich eine Redoxgleichung am Beispiel von Kupferoxid und Kohlenstoff aufgestellt.
Zusammenfassend kann gesagt werden, dass eine Redoxreaktion ein chemischer Prozess ist, bei dem Elektronen von einer Substanz zur anderen übertragen werden. Dabei tritt eine Oxidation und eine gleichzeitige Reduktion auf. Diese Reaktionen spielen eine wichtige Rolle in der Natur und in verschiedenen industriellen Anwendungen, da sie Energie freisetzen und chemische Veränderungen ermöglichen.

