Van-der-Waals-Kräfte sind intermolekulare Kräfte, die zwischen Molekülen wirken und für verschiedene physikalische Phänomene verantwortlich sind. Diese Kräfte entstehen durch temporäre Dipol-Dipol-Wechselwirkungen, Dipol-induzierte Dipol-Wechselwirkungen und Londoner Dispersionskräfte. Sie spielen eine wichtige Rolle in der Chemie und Physik und beeinflussen Eigenschaften wie Siedepunkt, Schmelzpunkt und Viskosität von Stoffen.
1. Van-der-Waals-Kräfte: Was sind sie und wie entstehen sie?
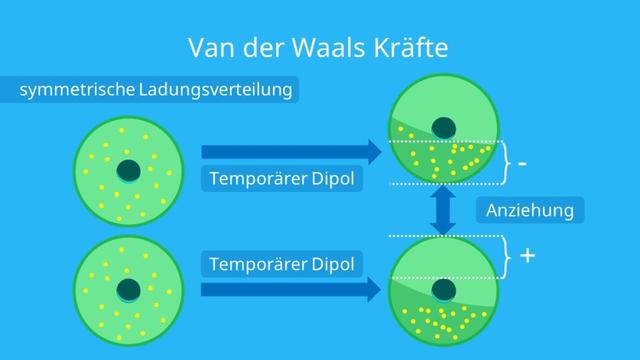
Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontaner Polarisation der Atome und Moleküle auftreten. Diese Kräfte werden in der Chemie zu den schwachen chemischen Bindungen gezählt, obwohl es sich nicht um echte Bindungen handelt, sondern um Wechselwirkungen. Van-der-Waals-Kräfte kommen zwischen fast allen Teilchen vor, jedoch überlagern meistens andere stärkere Bindungen und Wechselwirkungen wie Ionenbindungen oder Dipol-Dipol-Wechselwirkungen diese Kräfte.
Die Van-der-Waals-Kräfte entstehen durch spontane Ladungsverteilung in den Molekülen. Dabei entwickelt sich ein Molekül zu einem temporären Dipol, bei dem eine Seite negativ geladen ist und die andere leicht positiv geladen ist. Dieser Dipol beeinflusst wiederum andere Moleküle und zieht Elektronen mit der positiven Seite an. Dadurch entsteht ein weiterer Dipol, der als induzierter Dipol bezeichnet wird. Die unterschiedlich geladenen Bereiche der beiden Moleküle ziehen sich an und erzeugen eine elektrostatische Anziehungskraft, die als Van-der-Waals-Kraft bezeichnet wird.
Damit Van-der-Waals-Kräfte wirken können, müssen bestimmte Voraussetzungen erfüllt sein. Die betroffenen Moleküle müssen polarisierbar sein, das heißt sie müssen in der Lage sein, ihre Elektronenwolke zeitweise zu verformen. Außerdem dürfen die Moleküle keine Ladung tragen und keinen permanenten Dipol besitzen. Die Stärke der Van-der-Waals-Kräfte hängt auch vom Abstand der Moleküle zueinander ab. Je näher sich die Moleküle befinden, desto stärker sind die Kräfte.
Ein Beispiel für die Auswirkungen von Van-der-Waals-Kräften ist das Verhalten von Alkanen. Mit zunehmender Kettenlänge nehmen die Van-der-Waals-Kräfte zwischen den einzelnen Alkan-Molekülen zu, da sich die Oberfläche vergrößert. Dadurch steigt auch der Siedepunkt der Alkane. Verzweigte Alkane haben eine geringere Oberfläche und somit schwächere Van-der-Waals-Kräfte, weshalb sie niedrigere Siedepunkte haben.
Zusammenfassend sind Van-der-Waals-Kräfte schwache Anziehungskräfte zwischen ungeladenen Molekülen ohne permanenten Dipol. Diese Kräfte entstehen durch spontane Polarisation der Atome und Moleküle und wirken zwischen fast allen Teilchen, werden aber oft von stärkeren Bindungen überlagert.
2. Die Bedeutung der Van-der-Waals-Kräfte in der Chemie
Die Van-der-Waals-Kräfte spielen eine wichtige Rolle in der Chemie. Sie sind schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontanen Polarisationen der Atome auftreten. Diese Kräfte sind vor allem zwischen ungeladenen Molekülen wichtig, die keinen permanenten Dipol besitzen.
Ein Beispiel dafür sind die Alkane. Mit zunehmender Kettenlänge nehmen die Van-der-Waals-Kräfte zwischen den einzelnen Molekülen zu, da die Oberfläche langer Moleküle größer ist als die der kurzen Moleküle. Dies führt dazu, dass längere Alkane einen höheren Siedepunkt haben.
Auch bei anderen unpolaren Substanzen spielen die Van-der-Waals-Kräfte eine entscheidende Rolle für den Aggregatzustand. Ohne diese Kräfte könnten diese Substanzen nicht im flüssigen oder festen Zustand vorliegen.
Van-der-Waals-Bindungen können auch Festkörper zusammenhalten, wie zum Beispiel bei den Edelgaskristallen. Diese Kristalle beruhen allein auf den Van-der-Waals-Kräften und kommen nur bei sehr tiefen Temperaturen vor.
Ein weiteres Beispiel für die Bedeutung der Van-der-Waals-Kräfte findet sich bei Geckos. Durch ihre spezielle Anatomie und die Hafthärchen unter ihren Füßen können sie selbst auf spiegelglatten Oberflächen hochklettern oder kopfüber daran laufen, ohne herunterzufallen. Die Hafthärchen interagieren mittels Van-der-Waals-Kräften mit der Oberfläche und halten den Gecko fest.
Insgesamt sind die Van-der-Waals-Kräfte also eine wichtige Form der zwischenmolekularen Kräfte, die in vielen Bereichen der Chemie eine Rolle spielen.
3. Van-der-Waals-Kräfte zwischen Molekülen: Eine Erklärung
Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontaner Polarisation der Atome und Moleküle auftreten. Diese Kräfte spielen eine wichtige Rolle in der Chemie und sind für verschiedene Phänomene verantwortlich.
Die Van-der-Waals-Kräfte treten zwischen ungeladenen Molekülen auf, die keinen permanenten Dipol besitzen. Sie werden auch als London-Kräfte bezeichnet, benannt nach dem deutschen Physiker Fritz London, der ihre Existenz erstmals beschrieb.
Die Kräfte entstehen durch spontane Veränderungen in der Elektronenverteilung um den Atomkern. Normalerweise bewegen sich die Elektronen in Orbitalen um den Kern herum. Bei dieser Bewegung kann es jedoch zu einer temporären Ungleichverteilung der Elektronen kommen, wodurch das Molekül einen temporären Dipol entwickelt.
Wenn ein Molekül mit einem spontanen Dipol in die Nähe eines anderen Moleküls kommt, kann es einen induzierten Dipol in diesem Molekül erzeugen. Die unterschiedlich geladenen Bereiche ziehen sich an und es entsteht eine elektrostatische Anziehungskraft – die Van-der-Waals-Kraft.
Es ist wichtig zu beachten, dass Van-der-Waals-Kräfte sehr schwach sind im Vergleich zu anderen Bindungen wie Wasserstoffbrückenbindungen oder Ionenbindungen. Sie spielen jedoch eine wichtige Rolle bei der Stabilisierung von Molekülen und beeinflussen Eigenschaften wie Siedepunkte und Schmelzpunkte.
Um Van-der-Waals-Kräfte zu ermöglichen, müssen die Moleküle polarisierbar sein, was bedeutet, dass sie eine Elektronenverteilung haben, die leicht verändert werden kann. Außerdem müssen sich die Moleküle sehr nah sein, da die Stärke der Van-der-Waals-Kräfte vom Abstand abhängt. Je näher sich die Moleküle sind, desto stärker sind die Kräfte.
Ein Beispiel für die Auswirkungen von Van-der-Waals-Kräften ist das Verhalten von Alkanen. Mit zunehmender Kettenlänge nehmen die Siedepunkte der Alkane zu. Dies liegt daran, dass längere Alkane eine größere Oberfläche haben und daher mehr Van-der-Waals-Kräfte zwischen den Molekülen wirken können.
Ein weiteres interessantes Beispiel für Van-der-Waals-Kräfte sind Geckos, die dank dieser Kräfte an glatten Oberflächen haften können. Die Füße der Geckos haben winzige Hafthärchen, die mit Hilfe von Van-der-Waals-Kräften an den Oberflächen haften bleiben.
Insgesamt sind Van-der-Waals-Kräfte eine wichtige Art von intermolekularen Kräften in der Chemie. Sie spielen eine Rolle bei vielen Phänomenen und beeinflussen Eigenschaften von Molekülen und Materialien.
4. Die Rolle der Van-der-Waals-Kräfte bei Geckos

4. Die Rolle der Van-der-Waals-Kräfte bei Geckos
Die Fähigkeit von Geckos, selbst auf spiegelglatten Oberflächen zu klettern und kopfüber daran entlangzulaufen, ohne herunterzufallen, beruht auf der Anatomie ihrer Füße und den Van-der-Waals-Kräften. Obwohl die Füße der Geckos keine Saugnäpfe haben, können sie sich der Erdanziehungskraft widersetzen.
Die Unterseite der Füße von Geckos ist mit sogenannten Spatulae bedeckt, die nur 15 Nanometer dick sind. Diese Hafthärchen vergrößern die Oberfläche der Fußunterseite und schaffen dadurch eine größere Kontaktfläche. Jedes einzelne Hafthärchen interagiert mittels Van-der-Waals-Kräften mit Oberflächen. Die Summe dieser kleinen Kräfte addiert sich zu einer ausreichend starken Kraft von etwa 40 Newton, um den Gecko an der Decke zu halten.
Van-der-Waals-Kräfte sind Anziehungskräfte zwischen Molekülen, die spontan Dipole entwickeln. Ein Dipol entsteht durch eine ungleiche Ladungsverteilung im Molekül, wobei eine Seite negativ und die andere leicht positiv geladen ist. Diese unterschiedlich geladenen Bereiche ziehen sich gegenseitig an und erzeugen so die Van-der-Waals-Kraft.
Bei den Van-der-Waals-Kräften zwischen den Hafthärchen des Gecko-Fußes und der Oberfläche wirken temporäre Dipole. Diese entstehen durch spontane Polarisationen der Atome und Moleküle. Die positiv geladene Seite eines Moleküls zieht Elektronen des benachbarten neutralen Moleküls an, wodurch auch dieses einen temporären Dipol entwickelt. Die Anziehung zwischen den unterschiedlich geladenen Bereichen der Hafthärchen und der Oberfläche führt zur Haftung des Geckos.
Die Van-der-Waals-Kräfte spielen also eine entscheidende Rolle bei der Fähigkeit von Geckos, an Wänden und Decken zu haften, obwohl ihre Füße keine Saugnäpfe haben.
5. Van-der-Waals-Kräfte: Wirkung und Anwendungsbereiche
Die Van-der-Waals-Kräfte haben verschiedene Auswirkungen und Anwendungsbereiche. Hier sind einige Beispiele:
1. Aggregatzustände: Die Van-der-Waals-Kräfte spielen eine wichtige Rolle bei der Bestimmung des Aggregatzustands von Substanzen. Bei niedrigen Temperaturen können die Kräfte zwischen den Molekülen stark genug sein, um sie zu einem festen Zustand zu binden, wie es zum Beispiel bei Edelgaskristallen der Fall ist.
2. Siedepunkte: Die Stärke der Van-der-Waals-Kräfte beeinflusst auch die Siedepunkte von Substanzen. Je stärker die Kräfte zwischen den Molekülen sind, desto höher ist der Siedepunkt. Dies erklärt zum Beispiel, warum längere Alkane höhere Siedepunkte haben als kürzere Alkane.
3. Löslichkeit: Die Van-der-Waals-Kräfte spielen auch eine Rolle bei der Löslichkeit von Substanzen in Lösungsmitteln. Wenn die Kräfte zwischen den Molekülen einer Substanz und den Molekülen des Lösungsmittels stark genug sind, kann die Substanz in dem Lösungsmittel gelöst werden.
4. Oberflächenspannung: Die Van-der-Waals-Kräfte tragen zur Oberflächenspannung von Flüssigkeiten bei. Diese Kräfte ziehen die Moleküle an der Oberfläche einer Flüssigkeit nach innen und erzeugen so eine „Haut“ auf der Oberfläche.
5. Geckos und Haftung: Wie im vorherigen Abschnitt erwähnt, nutzen Geckos die Van-der-Waals-Kräfte, um an glatten Oberflächen zu haften. Die Hafthärchen unter ihren Füßen interagieren mit den Oberflächenmolekülen und erzeugen so eine starke Anziehungskraft.
6. Nanotechnologie: In der Nanotechnologie werden die Van-der-Waals-Kräfte genutzt, um winzige Strukturen zusammenzuhalten oder zu manipulieren. Diese Kräfte können verwendet werden, um Nanostrukturen auf Oberflächen anzubringen oder sie zu bewegen.
7. Wechselwirkungen zwischen Molekülen: Die Van-der-Waals-Kräfte spielen auch eine Rolle bei Wechselwirkungen zwischen Molekülen in chemischen Reaktionen. Sie können die Stabilität von Molekülstrukturen beeinflussen und sind wichtig für die Bildung von Biomolekülkomplexen.
Die Van-der-Waals-Kräfte sind also nicht nur für das Verständnis der Naturphänomene wie Geckohaftung wichtig, sondern haben auch zahlreiche Anwendungsbereiche in verschiedenen wissenschaftlichen und technologischen Bereichen.
6. Der Einfluss von Van-der-Waals-Kräften auf die Siedetemperatur von Molekülen

Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontanen Polarisationen der Atome auftreten. Diese Kräfte treten vor allem zwischen ungeladenen Molekülen auf, die keinen permanenten Dipol besitzen. Sie sind eine Form der intermolekularen Kräfte und werden in der Chemie zu den schwachen chemischen Bindungen gezählt.
Die Van-der-Waals-Kräfte kommen grundsätzlich zwischen fast allen Teilchen vor, jedoch sind sie meistens von anderen Bindungen oder Wechselwirkungen überdeckt, wie zum Beispiel Ionenbindungen oder Dipol-Dipol-Wechselwirkungen, die deutlich stärker sind. Daher spielen die Van-der-Waals-Kräfte oft eine untergeordnete Rolle.
Die Van-der-Waals-Kräfte entstehen durch spontane Polarisationen der Atome. Die Elektronen bewegen sich permanent um die Atomkerne in Orbitalen. Wenn zwei Atome eine Bindung eingehen, entsteht ein Bindungsorbital, innerhalb dessen sich die Elektronen bewegen. Es kann jedoch zu einer Ungleichverteilung der Elektronen um die Atomkerne kommen, wodurch das Molekül spontan ein positiv und ein negativ geladenes Ende hat – es bildet sich ein temporärer Dipol aus.
Ein Molekül mit einem solchen spontanen Dipol kann in einem benachbarten Molekül einen weiteren Dipol induzieren. Das positive Ende des ersten Moleküls zieht dabei die Elektronen des zweiten Moleküls auf eine Seite, wodurch auch das zweite Molekül eine ungleiche Elektronenverteilung im Bindungsorbital hat. Die Moleküle mit spontanen und induzierten Dipolen ziehen sich dann elektrostatisch an – das sind die Van-der-Waals-Kräfte.
Damit diese Kräfte wirken können, müssen sich die Moleküle sehr nah sein. Die Stärke der Van-der-Waals-Kräfte ist proportional zur negativen sechsten Potenz des Abstands zwischen den Molekülen. Je größer der Abstand, desto schwächer sind die Kräfte. Eine Annäherung wird jedoch schwieriger, je höher die Temperatur ist, da dann die thermische Bewegung der Teilchen überwiegt und die Van-der-Waals-Kräfte überwunden werden können.
Die Van-der-Waals-Kräfte haben Einfluss auf die Eigenschaften von Substanzen. Zum Beispiel nehmen mit zunehmender Kettenlänge bei Alkanen die Van-der-Waals-Kräfte zu, was zu höheren Siedepunkten führt. Dies liegt daran, dass längere Moleküle eine größere Oberfläche haben und somit mehr Van-der-Waals-Kräfte zwischen den einzelnen Ketten wirken (die Kräfte addieren sich). Daher braucht es eine höhere Temperatur, um diese Kräfte zu überwinden.
Auch verzweigte Alkane haben niedrigere Siedepunkte als lineare Alkane, da mit steigender Verzweigung die Oberfläche verringert wird und somit weniger Van-der-Waals-Kräfte zwischen den Molekülen wirken können.
Van-der-Waals-Kräfte spielen auch eine Rolle bei der Haftung von Geckos an glatten Oberflächen. Die Füße der Geckos haben Hafthärchen, die durch Van-der-Waals-Kräfte mit der Oberfläche interagieren. Diese kleinen Kräfte addieren sich zu einer Gesamtkraft, die ausreicht, um den Gecko an der Decke zu halten.
Zusammenfassend sind Van-der-Waals-Kräfte schwache Anziehungskräfte zwischen Molekülen, die aufgrund von spontanen Polarisationen entstehen. Sie kommen zwischen ungeladenen Molekülen vor und sind abhängig vom Abstand zwischen den Teilchen. Diese Kräfte beeinflussen die Eigenschaften von Substanzen und spielen auch eine Rolle bei der Haftung von Geckos an glatten Oberflächen.
Zusammenfassend lassen sich Van-der-Waals-Kräfte als schwache Anziehungskräfte zwischen Molekülen beschreiben, die durch temporäre Dipolmomente oder Induktionswirkungen entstehen. Sie spielen eine wichtige Rolle in verschiedenen physikalischen und chemischen Phänomenen, wie zum Beispiel der Aggregation von Teilchen oder dem Zustandekommen der Kondensation und Verdampfung von Flüssigkeiten. Obwohl sie im Vergleich zu anderen Kräften relativ schwach sind, tragen sie dennoch maßgeblich zur Stabilität und Eigenschaften von Materie bei.

