Kationen sind positiv geladene Teilchen, die in der Chemie eine wichtige Rolle spielen. In diesem Artikel werden wir uns genauer mit der Definition, den Eigenschaften und der Bedeutung von Kationen beschäftigen. Lassen Sie uns eintauchen und mehr über diese faszinierenden chemischen Spezies erfahren!
Grundlagen der Kationen: Was sind Kationen und wie entstehen sie?
Was sind Kationen?
Kationen sind positiv geladene Ionen, die entstehen, wenn ein Atom weniger Elektronen als Protonen besitzt. Ein Atom besteht aus einem positiv geladenen Atomkern, der Protonen enthält, und einer negativ geladenen Atomhülle, die Elektronen enthält. Wenn ein Atom mehr Elektronen abgibt als aufnimmt, überwiegt die positive Ladung im Atomkern und es entsteht ein Kation.
Wie entstehen Kationen?
Kationen entstehen durch eine Elektronenübertragung zwischen zwei Atomen. Dabei gibt ein Atom Elektron(en) ab und wird oxidiert, während das andere Atom diese Elektron(en) aufnimmt und reduziert wird. Eine Oxidation bezeichnet den Vorgang des Elektronenabgebens, während eine Reduktion den Vorgang des Elektronenaufnehmens beschreibt. Durch diese Redoxreaktion entstehen Kationen.
Es gibt auch verschiedene Bedingungen, die beeinflussen können, ob eine Elektronenübertragung zwischen zwei Atomen stattfindet. Dazu gehören unter anderem die Temperatur und das Standardelektrodenpotential. Das Standardelektrodenpotential gibt an, wie willig ein Atom ist, Elektron(en) abzugeben. Je niedriger das Standardelektrodenpotential eines Atoms ist, desto einfacher kann es zum Kation werden.
Insgesamt spielen Kationen eine wichtige Rolle in der Chemie und haben verschiedene Anwendungen, zum Beispiel bei der Gewinnung von Metallen.
Die chemische Bedeutung von Kationen: Warum sind sie wichtig?
Kationen in biologischen Prozessen
Kationen spielen eine wichtige Rolle in biologischen Prozessen. Sie sind an vielen grundlegenden Funktionen des Körpers beteiligt, wie zum Beispiel der Signalübertragung zwischen Nervenzellen oder der Regulierung des pH-Werts im Blut. Ein bekanntes Beispiel für die Bedeutung von Kationen ist das Kaliumion (K+), das für die Erregbarkeit von Nervenzellen und Muskelzellen unerlässlich ist.
Kationen in der Chemie und Industrie
In der Chemie und Industrie haben Kationen ebenfalls eine große Bedeutung. Viele chemische Reaktionen basieren auf der Wechselwirkung von Kationen mit Anionen, um neue Verbindungen zu bilden. Darüber hinaus werden Kationen auch zur Herstellung von Metallen verwendet. Durch Elektrolyse können Metallkationen aus ihren Verbindungen gewonnen werden, was für die Produktion verschiedener Metalle von großer Bedeutung ist.
Verwendung von Kationenaustauschern
Ein weiterer wichtiger Aspekt ist die Verwendung von Kationenaustauschern. Diese Materialien können bestimmte Kationen aus Lösungen entfernen und durch andere ersetzen. Dies wird beispielsweise in Wasserreinigungsanlagen eingesetzt, um schädliche Schwermetallionen zu entfernen und das Wasser zu reinigen.
Zusammenfassend kann gesagt werden, dass Kationen eine entscheidende Rolle in biologischen Prozessen, der Chemie und Industrie spielen. Sie sind essenziell für die Funktion des Körpers und ermöglichen chemische Reaktionen sowie die Herstellung von Metallen. Die Verwendung von Kationenaustauschern ist ebenfalls von großer Bedeutung für verschiedene Anwendungen.
Kationen in der Biologie: Wie beeinflussen sie den Transport von Sauerstoff im Blut?
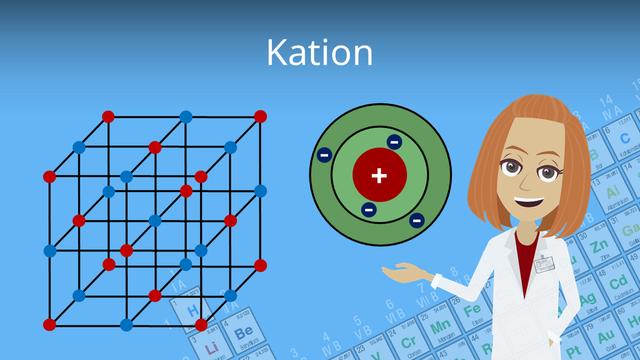
Die Rolle der Kationen bei der Bindung von Sauerstoff
Die roten Blutkörperchen im Blut spielen eine entscheidende Rolle beim Transport von Sauerstoff zu den Organen. Doch wie gelingt es ihnen, Sauerstoffmoleküle zu binden? Hier kommen die Kationen ins Spiel. Ein Kation ist ein positiv geladenes Ion, das weniger Elektronen als Protonen hat. In diesem Fall handelt es sich um das Eisenkation (Fe2+), das in den roten Blutkörperchen vorkommt. Das Sauerstoffmolekül besitzt hingegen freie Elektronenpaare und ist negativ geladen. Aufgrund dieser gegensätzlichen Ladungen zieht das Eisenkation das Sauerstoffatom an und ermöglicht so den Transport durch den Körper.
Die Bedeutung von Kationen für den Lernprozess
Kationen sind nicht nur in der Biologie wichtig, sondern haben auch eine große Bedeutung für unseren Lernerfolg. In der App StudySmarter kannst du kostenlos ein Konto erstellen und alle Materialien speichern, die du für dein Studium benötigst. Mit über 200 Millionen kostenlosen Materialien bietet die App alles, was du für deinen Lernerfolg brauchst. Du kannst mit Freunden lernen, deine persönlichen Lernstatistiken verfolgen und dich mit Erinnerungen daran erinnern lassen, regelmäßig zu lernen und nicht zu prokrastinieren. StudySmarter ist die einzige Lernapp, die du brauchst, um erfolgreich zu lernen.
Kationen und Elektrochemie: Eine Einführung in die Welt der Metallkationen.
Die Welt der Metallkationen ist ein faszinierendes Gebiet in der Elektrochemie. Metallkationen spielen eine wichtige Rolle in vielen industriellen Anwendungen und haben große Bedeutung für die chemische Industrie. In diesem Artikel werden wir einen Einblick in die Welt der Metallkationen geben und ihre Bedeutung in der Elektrochemie erklären.
Was sind Kationen?
Kationen sind positiv geladene Ionen, die entstehen, wenn ein Atom Elektronen abgibt. Sie haben weniger Elektronen als Protonen und besitzen daher eine positive Ladung. Kationen können aus Elementen oder Anionen entstehen, indem sie genug Elektronen abgeben, um eine positive Ladung zu erhalten.
Die Bedeutung von Metallkationen
Metallkationen sind besonders interessant, da sie für die Gewinnung von Metallen von großer Bedeutung sind. Durch elektrochemische Prozesse können Metalle aus ihren Verbindungen gewonnen werden. Dabei werden Metallionen reduziert und bilden das entsprechende Metall.
Ein Beispiel dafür ist die Gewinnung von Aluminium aus Aluminiumoxid (Al2O3). Bei diesem Prozess wird das Aluminiumion (Al3+) reduziert und bildet reines Aluminiummetall.
Metallkationen spielen auch eine wichtige Rolle in Batterien und Brennstoffzellen. In diesen Geräten findet eine elektrochemische Reaktion statt, bei der Metallkationen reduziert und wieder oxidiert werden. Dadurch entsteht ein Stromfluss, der zur Energiegewinnung genutzt werden kann.
Metallkationen in der Technik
Metalle haben aufgrund ihrer Eigenschaften eine Vielzahl von Anwendungen in der Technik. Sie sind zum Beispiel wichtig für den Bau von Maschinen, Fahrzeugen und Gebäuden. Metallkationen wie Eisen, Kupfer und Aluminium werden für die Herstellung von Stahl, Kupferdrähten und Aluminiumlegierungen verwendet.
In der Elektrotechnik spielen Metallkationen eine große Rolle bei der Herstellung von Leitern und Schaltern. Metalle wie Silber, Gold und Kupfer haben eine hohe elektrische Leitfähigkeit und ermöglichen einen effizienten Stromfluss.
Zusammenfassend lässt sich sagen, dass Metallkationen eine wichtige Rolle in der Elektrochemie spielen. Sie sind für die Gewinnung von Metallen, Batterien und Brennstoffzellen unverzichtbar. Darüber hinaus haben sie vielfältige Anwendungen in der Technik und sind entscheidend für den Bau von Maschinen, Fahrzeugen und Gebäuden.
Wertigkeit von Kationen: Warum haben manche Elemente unterschiedliche Ladungen?
Grundlage für das Verständnis von Kationen
Ein Atom besteht aus einem Atomkern und einer Atomhülle. Der Atomkern enthält Protonen, die positiv geladen sind, während die Atomhülle Elektronen, die negativ geladen sind, enthält. Die Anzahl der Protonen und Elektronen ist normalerweise gleich, wodurch das Atom elektrisch neutral ist. Wenn jedoch ein Atom mehr oder weniger Elektronen als Protonen hat, entsteht ein Ion. Kationen sind positiv geladene Ionen, bei denen das Atom weniger Elektronen als Protonen besitzt.
Entstehung von Kationen
Kationen entstehen durch eine Elektronenübertragung zwischen zwei Atomen. Dabei gibt ein Atom Elektronen ab (Oxidation), während ein anderes Atom diese Elektronen aufnimmt (Reduktion). Durch diese Übertragung haben die entstandenen Kationen weniger Elektronen als Protonen und sind somit positiv geladen.
Standardelektrodenpotential
Ob eine Elektronenübertragung zwischen zwei Atomen stattfindet, hängt unter anderem vom Standardelektrodenpotential ab. Dieses gibt an, wie willig ein Atom ist, Elektronen abzugeben. Je niedriger das Standardelektrodenpotential eines Atoms ist, desto höher ist sein Bestreben, Elektronen abzugeben.
Einfache und zusammengesetzte Kationen
Kationen können entweder aus einem einzelnen Atom (einfache Kationen) oder aus mehreren Atomen (zusammengesetzte Kationen) bestehen. Einfache Kationen haben nur eine bestimmte Wertigkeit, während zusammengesetzte Kationen unterschiedliche Wertigkeiten haben können.
Metallkationen
Eine wichtige Gruppe von einfachen Kationen sind die Metallkationen. Diese gehören zu den Elementen der ersten, zweiten und dritten Hauptgruppe sowie einigen Elementen aus den Nebengruppen. Die Wertigkeit der Metallkationen kann aus der Zahl der Hauptgruppe abgelesen werden.
Verteilung der Elektronen auf Schalen
Die unterschiedlichen Anzahlen von Elektronen bei verschiedenen Elementen resultieren aus der Verteilung der Elektronen auf Schalen. Jede Schale entspricht einer bestimmten Kreisbahn um den Atomkern. Die Anzahl der Elektronen pro Schale kann im Periodensystem abgelesen werden. Um die äußere Schale vollständig zu besetzen, ist es für manche Elemente einfacher, Elektronen abzugeben als aufzunehmen.
Diese Erklärung zur Wertigkeit von Kationen bietet einen Einblick in die chemischen Grundlagen hinter dem Transport von Sauerstoff durch rote Blutkörperchen im Blut. Durch das Verständnis dieser Konzepte wird deutlich, wie sich Ionen bilden und welche Rolle sie in chemischen Reaktionen spielen.
Anwendungen von Kationen in der chemischen Industrie: Wie werden Metalle aus ihnen gewonnen?
Kationen, insbesondere Metallkationen, spielen eine wichtige Rolle in der chemischen Industrie, da sie die Grundlage für die Gewinnung von Metallen bilden. Metalle haben eine Vielzahl von Anwendungen in verschiedenen Bereichen wie Technik, Bauwesen und Elektronik.
Ein Beispiel für die Anwendung von Kationen in der chemischen Industrie ist die Gewinnung von Aluminium aus Aluminiumoxid (Al2O3). Aluminiumoxid ist ein Mineral, das häufig als Tonerde bezeichnet wird und als Rohstoff für die Aluminiumproduktion dient. Durch einen elektrolytischen Prozess können Aluminiumionen (Al3+) aus dem Aluminiumoxid extrahiert werden. Diese Ionen werden dann zu flüssigem Aluminium reduziert und können weiterverarbeitet werden.
Ein weiteres Beispiel ist die Gewinnung von Eisen aus Eisenerz. Eisen kommt in der Natur hauptsächlich als Eisenoxid vor. Um das Eisen zu gewinnen, wird das Eisenerz zunächst zerkleinert und mit Kohlenstoff gemischt. Durch Erhitzen des Gemisches entsteht Kohlenmonoxid (CO), das mit dem Eisenoxid reagiert und reduziert wird. Dabei entstehen Eisenionen (Fe2+), die anschließend zu festem Eisen reduziert werden können.
Neben der Metallgewinnung haben Kationen auch andere Anwendungen in der chemischen Industrie. Ein Beispiel sind Katalysatoren, die oft auf Basis von Übergangsmetallkationen hergestellt werden. Diese Katalysatoren beschleunigen chemische Reaktionen, indem sie den Reaktionsweg erleichtern und die Aktivierungsenergie verringern.
Zusammenfassend lässt sich sagen, dass Kationen, insbesondere Metallkationen, eine wichtige Rolle in der chemischen Industrie spielen. Sie dienen als Ausgangsstoffe für die Gewinnung von Metallen und werden auch in anderen Anwendungen wie Katalysatoren eingesetzt. Die Kenntnis der Eigenschaften und Anwendungen von Kationen ist daher für die chemische Industrie unerlässlich.
Zusammenfassend sind Kationen positiv geladene Ionen, die durch den Verlust von Elektronen entstehen. Sie spielen eine wichtige Rolle in chemischen Reaktionen und haben verschiedene Eigenschaften und Anwendungen in der Natur und Technologie. Ein Verständnis der Kationen ist daher grundlegend für das Verständnis der Chemie.

