Alkane sind eine wichtige Gruppe von organischen Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen bestehen. Sie zeichnen sich durch ihre einfache Struktur und hohe Stabilität aus. In diesem Artikel werden wir näher auf die Eigenschaften, Vorkommen und Anwendungen der Alkane eingehen. Lassen Sie uns tiefer in die faszinierende Welt dieser Verbindungen eintauchen!
- Solarzelle selber bauen: Eine Anleitung für den DIY-Spaß
- Wie alt dürfen Autoreifen beim TÜV sein?
- Lang und gesund leben: Die Lebensdauer von Labradoren im Vergleich zu anderen Hunderassen
- Köstlicher Grießpudding: Schnelles und einfaches Rezept für zu Hause
- Was reimt sich auf Freunde? Finden Sie die besten Reime auf Reimsuche.de!
Alkane: Grundbegriffe, Eigenschaften und Verwendung
Die organische Chemie beschäftigt sich unter anderem mit den Alkanen, einer wichtigen Stoffgruppe. Alkane sind Moleküle, die nur aus den Elementen Kohlenstoff und Wasserstoff bestehen. Sie enthalten ausschließlich Einfachbindungen zwischen den beiden Elementen und werden daher auch als gesättigte Kohlenwasserstoffe bezeichnet.
Alkane können sowohl unverzweigte (n-Alkane) als auch verzweigte (i-Alkane) Ketten bilden. Je nach Anzahl der Kohlenstoffatome gibt es viele verschiedene Alkane, von gasförmigen über flüssige bis hin zu festen Formen. In der Natur kommen sie zum Beispiel als Bestandteile in Erdöl und Erdgas vor.
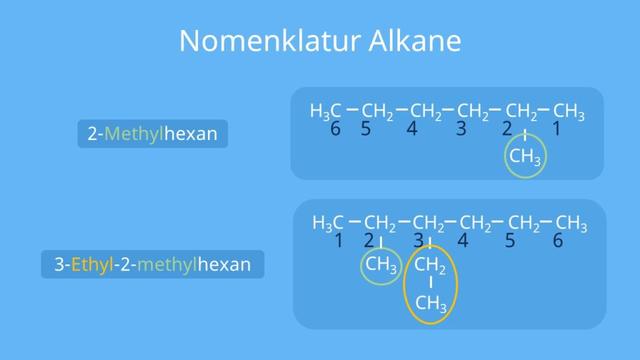
Die Benennung von Alkanen erfolgt nach bestimmten Regeln der IUPAC-Nomenklatur. Dabei werden die Anzahl der Kohlenstoffatome in der längsten Molekülkette mit griechischen Zahlenworten angegeben, gefolgt von Angaben zu eventuellen Seitenketten. Durch ihre einfache Struktur sind Alkane eher reaktionsarm und können unter normalen Bedingungen nur unter drastischen Bedingungen reagieren.
Alkane haben zwei große Verwendungsgebiete: Zum einen werden sie als Heiz- und Brennstoffe zur Energieerzeugung genutzt, wie zum Beispiel Methan oder Propan und Butan als Flüssiggas. Zum anderen dienen sie als wichtige Grundstoffe in der chemischen Industrie zur Herstellung von einfachen organischen Verbindungen oder Kunststoffen wie Polyethylen.
Die Eigenschaften der Alkane hängen von ihrer Kettenlänge ab. Je länger die Kette, desto höher sind die Schmelz- und Siedetemperaturen. Verzweigte Moleküle haben im Vergleich zu unverzweigten niedrigere Schmelz- und Siedepunkte. Alkane sind in Wasser schlecht löslich, aber untereinander gut mischbar.
Insgesamt bieten Alkane eine Vielzahl von Möglichkeiten für weitere Untersuchungen und Anwendungen in der organischen Chemie.
Alkane: Aufbau, Benennung und Vorkommen
Alkane sind eine wichtige Stoffgruppe in der organischen Chemie. Sie bestehen nur aus den Elementen Kohlenstoff (C) und Wasserstoff (H) und enthalten ausschließlich Einfachbindungen. Aufgrund dieser Eigenschaft werden sie auch als gesättigte Kohlenwasserstoffe bezeichnet.
Es gibt zwei Arten von Alkanen: unverzweigte (n-Alkane) und verzweigte (i-Alkane). Unverzweigte Alkane bilden gerade Ketten, während verzweigte Alkane Seitenketten haben. Die Anzahl der Kohlenstoffatome in einem Alkanmolekül kann variieren, wodurch es viele verschiedene Alkane gibt.
In der Natur kommen Alkane als Bestandteile in Erdöl und Erdgas vor. Sie können gasförmig, flüssig oder fest sein, abhängig von ihrer Kettenlänge. Je mehr Kohlenstoffatome ein Alkan besitzt, desto höher ist seine Schmelz- und Siedetemperatur.
Die Benennung von Alkanen erfolgt nach bestimmten Regeln der IUPAC-Nomenklatur. Dabei wird die Anzahl der Kohlenstoffatome in der längsten Molekülkette mit einem griechischen Zahlenwort angegeben. Wenn es Seitenketten gibt, werden ihre Länge und Position angegeben.
Alkane sind unpolar und lösen sich daher schlecht in Wasser, da Wasser ein polares Molekül ist. Allerdings können flüssige Alkane untereinander problemlos gemischt werden.
Alkane reagieren nur unter sehr drastischen Bedingungen, da sie wenig reaktionsfreudig sind. Die beiden wichtigsten Reaktionen von Alkanen sind die Verbrennung und die radikalische Substitution mit Halogenmolekülen.
Alkane haben verschiedene Anwendungsgebiete. Sie werden als Heiz- und Brennstoffe zur Energieerzeugung verwendet, wie beispielsweise Methan in Erdgas oder Propan und Butan als Flüssiggas. Außerdem dienen sie als Grundstoffe in der chemischen Industrie zur Herstellung von organischen Verbindungen und Kunststoffen.
Zusätzlich zu ihrer industriellen Verwendung kommen Alkane auch in einigen Lebewesen vor. Bestimmte Archaeen können Methan aus Kohlenstoffdioxid produzieren und nutzen es zur Energiegewinnung.
Wenn du mehr über Alkane erfahren möchtest, empfehlen wir dir unser ausführlicheres Video zu diesem Thema anzuschauen, in dem wir unter anderem verschiedene Darstellungsformen von Alkanen erklären und die Ringspannung behandeln.
Alkane in der organischen Chemie: Grundlagen und Anwendungen
Die organische Chemie umfasst verschiedene Stoffgruppen, darunter auch die Alkane. Alkane sind eine wichtige Gruppe von Kohlenwasserstoffen, die aus den Elementen Kohlenstoff (C) und Wasserstoff (H) bestehen. Sie enthalten nur Einfachbindungen zwischen den beiden Elementen und werden daher als gesättigte Kohlenwasserstoffe bezeichnet.
Alkane können entweder unverzweigt (n-Alkane) oder verzweigt (i-Alkane) vorkommen. Je nach Anzahl der Kohlenstoffatome in der Molekülkette haben sie unterschiedliche Eigenschaften. Einige Alkane sind gasförmig, andere flüssig oder fest. Sie kommen natürlicherweise in Erdöl und Erdgas vor.
Die Benennung von Alkanen erfolgt nach bestimmten Regeln, die durch die IUPAC-Nomenklatur festgelegt sind. Durch die Benennung kann jedes beliebige Alkan eindeutig identifiziert werden.
Alkane haben verschiedene Anwendungen. Sie dienen als Heiz- und Brennstoffe zur Energieerzeugung, wie zum Beispiel Methan als Hauptbestandteil von Erdgas oder Propan und Butan als Flüssiggas. Außerdem sind sie wichtige Grundstoffe in der chemischen Industrie zur Herstellung von organischen Verbindungen wie Methanol oder Kunststoffen wie Polyethylen.
Insgesamt bieten Alkane eine Vielzahl von Möglichkeiten für Forschung und Anwendungen in der organischen Chemie.
Alkane: Struktur, Eigenschaften und Verwendungsmöglichkeiten
Die organische Chemie umfasst verschiedene Stoffgruppen, darunter auch die Alkane. Alkane sind eine wichtige Gruppe von Kohlenwasserstoffen, die nur aus den Elementen Kohlenstoff (C) und Wasserstoff (H) bestehen. Sie werden auch als gesättigte Kohlenwasserstoffe bezeichnet, da sie nur Einfachbindungen zwischen den Atomen enthalten.
Alkane können in unverzweigter Form (n-Alkane) oder mit Seitenketten (i-Alkane) vorkommen. Ihre Strukturformel besteht aus einer Kette von Kohlenstoffatomen, die jeweils mit vier weiteren Atomen über Einfachbindungen verbunden sind. Je nach Anzahl der Kohlenstoffatome in der längsten Molekülkette werden sie unterschiedlich benannt.
Die Eigenschaften der Alkane hängen von ihrer Kettenlänge ab. Alkane mit bis zu 4 Kohlenstoffatomen sind Gase, während solche mit 5-20 Kohlenstoffatomen flüssig sind und solche mit mehr als 20 Kohlenstoffatomen fest sind. Alkane sind unpolar und weisen daher schwache Van-der-Waals-Kräfte zwischen den Molekülen auf. Dies führt zu niedrigen Schmelz- und Siedetemperaturen im Vergleich zu polaren Verbindungen.
Alkane haben verschiedene Verwendungsmöglichkeiten. Sie dienen als Heiz- und Brennstoffe zur Energieerzeugung, wie zum Beispiel Methan als Hauptbestandteil von Erdgas oder Propan und Butan als Flüssiggas. Darüber hinaus sind sie wichtige Grundstoffe in der chemischen Industrie und können zu verschiedenen organischen Verbindungen oder Kunststoffen weiterverarbeitet werden.
Insgesamt sind Alkane eine vielseitige Stoffgruppe in der organischen Chemie, die aufgrund ihrer einfachen Struktur und ihrer Eigenschaften in verschiedenen Bereichen Anwendung finden.
Wichtige Informationen zu Alkanen in der organischen Chemie
Alkane sind eine wichtige Stoffgruppe in der organischen Chemie. Sie bestehen nur aus den Elementen Kohlenstoff und Wasserstoff und enthalten ausschließlich Einfachbindungen zwischen den beiden Elementen. Daher werden sie auch als gesättigte Kohlenwasserstoffe bezeichnet.
Alkane können gerade Ketten (n-Alkane) oder verzweigte Ketten (i-Alkane) bilden. Es gibt viele verschiedene Alkane, von denen einige gasförmig, flüssig oder fest sein können. In der Natur kommen Alkane zum Beispiel als Bestandteile in Erdöl und Erdgas vor.
Grundbegriffe
- Alkane bestehen nur aus den Elementen Kohlenstoff (C) und Wasserstoff (H).
- Sie enthalten ausschließlich Einfachbindungen zwischen den Atomen.
- Kohlenstoffatome im Molekül sind mit vier weiteren Atomen über Einfachbindungen verbunden.
- Alkane können gerade oder verzweigte Ketten bilden.
- Sie werden auch als gesättigte Kohlenwasserstoffe bezeichnet.
Eigenschaften von Alkanen
- Je länger die Kette der Kohlenstoffatome, desto höher ist die Schmelz- und Siedetemperatur.
- Verzweigte Moleküle haben niedrigere Schmelz- und Siedetemperaturen als unverzweigte.
- Alkane sind in Wasser schlecht löslich, aber gut untereinander mischbar.
Reaktionen von Alkanen
- Alkane können mit Sauerstoff verbrennen und dienen als Hauptenergiequelle.
- Bei unvollständiger Verbrennung entstehen Nebenprodukte wie Kohlenstoffmonoxid oder Ruß.
- Alkane können mit Halogenmolekülen reagieren und Halogenalkane bilden.
Verwendung von Alkanen
- Als Heiz- und Brennstoffe zur Energieerzeugung, z.B. Methan in Erdgas oder Propan und Butan als Flüssiggas.
- Als Grundstoffe in der chemischen Industrie zur Herstellung von organischen Verbindungen wie Methanol oder Kunststoffen wie Polyethylen (PE).
Dies sind wichtige Informationen zu Alkanen in der organischen Chemie. Wenn du mehr über dieses Thema erfahren möchtest, schau dir unser ausführlicheres Video dazu an.
Alkane: Eine Einführung in die Stoffgruppe und ihre Bedeutung
Die organische Chemie umfasst eine Vielzahl von Stoffgruppen, darunter auch die Alkane. Alkane sind gesättigte Kohlenwasserstoffe, die nur aus den Elementen Kohlenstoff (C) und Wasserstoff (H) bestehen. Sie enthalten ausschließlich Einfachbindungen zwischen den beiden Elementen und keine Doppelbindungen. Aufgrund dieser Eigenschaft werden sie auch als gesättigte Kohlenwasserstoffe bezeichnet.
Alkane können in unverzweigter Form, also als gerade Ketten (n-Alkane), oder mit Seitenketten verzweigt (i-Alkane) vorkommen. Ihre Struktur ist relativ einfach, aber es gibt eine große Vielfalt an verschiedenen Alkanen. Einige sind gasförmig, andere flüssig oder fest. In der Natur kommen Alkane beispielsweise als Bestandteile in Erdöl und Erdgas vor.
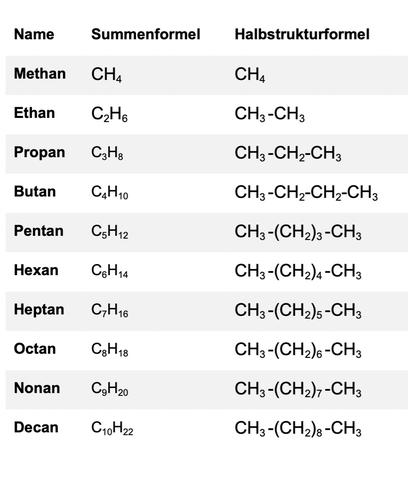
Die einfachsten n-Alkane sind Methan, Ethan, Propan und Butan. Methan besteht aus einem Kohlenstoffatom und vier Wasserstoffatomen (CH4). Durch das Hinzufügen von CH2-Gruppen erhält man die weiteren Mitglieder der Alkanfamilie. Je mehr Kohlenstoffatome ein Alkan besitzt, desto mehr Möglichkeiten gibt es für verschiedene Verknüpfungen dieser Atome.
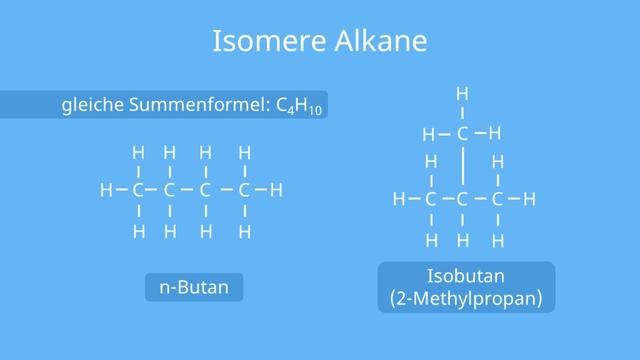
Bei verzweigten Alkanen können die Kohlenstoffatome unterschiedlich miteinander verbunden sein, obwohl sie dieselbe Summenformel haben. Dies nennt man Isomere oder genauer gesagt Konstitutionsisomere. Ein Beispiel dafür sind n-Butan und iso-Butan (2-Methyl-propan), die beide die Summenformel C4H10 haben, aber unterschiedlich aufgebaut sind.
Um Alkane einheitlich zu benennen, gibt es feste Regeln der IUPAC-Nomenklatur. Mit dieser Nomenklatur kann jedes beliebige Alkan eindeutig benannt werden.
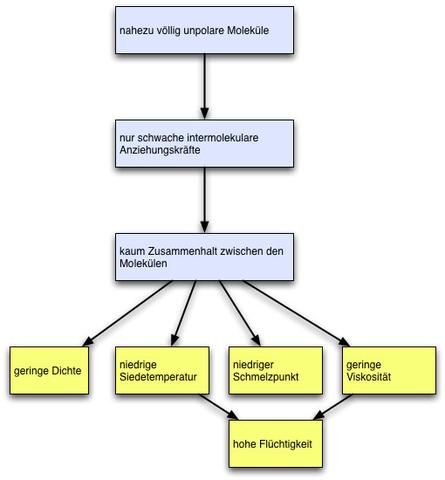
Die Eigenschaften von Alkanen sind sehr ähnlich. Sie können je nach Kettenlänge in verschiedenen Aggregatzuständen vorkommen. Die Siede- und Schmelztemperaturen der Alkane sind im Vergleich zu polaren Molekülen wie Alkoholen niedrig, da zwischen den Molekülen nur schwache Van-der-Waals-Kräfte wirken. Je länger die Kette der Kohlenstoffatome ist, desto höher sind die Schmelz- und Siedetemperaturen.
Alkane sind in Wasser schlecht löslich, aber untereinander gut mischbar. Dies liegt daran, dass Wasser ein polares Molekül ist und zwischen den unpolaren Alkanmolekülen nur schwache Van-der-Waals-Kräfte wirken.
Alkane können nur unter drastischen Bedingungen reagieren und sind daher wenig reaktionsfreudig. Die beiden wichtigsten Reaktionen von Alkanen sind Verbrennung und radikalische Substitution.
Die Verbrennung von Alkanen ist eine wichtige Energiequelle in unserer Gesellschaft. Bei vollständiger Verbrennung reagiert ein Alkan mit ausreichend Sauerstoff zu Kohlendioxid und Wasser. Bei unvollständiger Verbrennung entstehen unerwünschte Nebenprodukte wie Kohlenstoffmonoxid oder Ruß.
Bei der radikalischen Substitution werden Wasserstoffatome in Alkanen durch Halogenatome ersetzt. Dabei entstehen Halogenalkane. Diese Reaktion findet unter Zugabe von Energie, meist in Form von UV-Licht, statt.
Alkane haben verschiedene Verwendungsgebiete. Sie dienen als Heiz- und Brennstoffe zur Energieerzeugung, zum Beispiel Methan als Hauptbestandteil von Erdgas. Sie sind auch wichtige Grundstoffe der chemischen Industrie und können zu verschiedenen organischen Verbindungen und Kunststoffen weiterverarbeitet werden.
Es gibt noch viele weitere interessante Aspekte zu entdecken, wenn es um Alkane geht. Wenn du tiefer in das Thema einsteigen möchtest, empfehlen wir dir unser ausführlicheres Video zu den Alkanen anzuschauen.
Zusammenfassend sind Alkane eine Gruppe von organischen Verbindungen, die aus Kohlenstoff- und Wasserstoffatomen bestehen. Sie haben eine einfache Struktur und kommen in vielen natürlichen Ressourcen vor. Alkane finden breite Anwendung in verschiedenen Bereichen wie der Energiegewinnung, als Lösungsmittel und in der Chemieindustrie. Ihr Hauptmerkmal ist ihre Sättigung mit Wasserstoffatomen, was sie stabiler macht als andere organische Verbindungen.

