„Was ist Sublimieren? Eine kurze Einführung in das Phänomen der Sublimation und ihre Bedeutung. Erfahren Sie, wie Sublimieren eine Stoffumwandlung beschreibt, bei der ein fester Stoff direkt in einen gasförmigen Zustand übergeht, ohne zu schmelzen. Entdecken Sie die vielfältigen Anwendungen dieses Prozesses in verschiedenen Bereichen wie Chemie, Physik und sogar in unserem täglichen Leben.“
Was ist Sublimieren? Eine Erklärung des physikalischen Vorgangs
Beim Sublimieren handelt es sich um einen physikalischen Vorgang, bei dem ein Stoff direkt vom festen in den gasförmigen Aggregatzustand übergeht. Dies geschieht bereits bei Temperaturen unterhalb der Schmelztemperatur des Stoffes. Um diesen Übergang zu ermöglichen, ist Wärme erforderlich. Der gegenteilige Prozess zum Sublimieren wird als Resublimation bezeichnet, bei dem der Aggregatzustand eines Stoffes von gasförmig zu fest wechselt und dabei Wärme freigesetzt wird. Die Resublimation findet bei Temperaturen oberhalb der Siedetemperatur statt und überspringt normalerweise den flüssigen Zustand. Ein bekanntes Beispiel für die Sublimation ist das Verdampfen und Kondensieren von Wasser im Winter, wo Schnee direkt in Wasserdampf und umgekehrt umgewandelt werden kann.
Sublimation von Wasser
Im Winter kann man die Sublimation von Wasser gut beobachten. Wenn Schnee auf dem Boden liegt, nimmt seine Menge trotz kalter Temperaturen ab. Das liegt daran, dass der Schnee nicht schmilzt, sondern direkt vom festen in den gasförmigen Zustand übergeht. Der Schmelzpunkt von Wasser beträgt 0°C, aber die Sublimation kann auch bei Minusgraden stattfinden. Bei der Resublimation wandelt sich der Wasserdampf dann wieder in feste Form um und bildet Reif auf Gras oder anderen Oberflächen.
Sublimation und Resublimation von Iod
Ein weiteres Beispiel für Sublimation und Resublimation ist die Verbindung Iod. Wenn festes Iod erhitzt wird, bildet sich violettes Gas, das direkt in feste Kristalle übergeht, wenn es wieder abkühlt. Dabei wird der flüssige Zustand übersprungen.
Um den physikalischen Vorgang des Sublimierens zu verstehen, betrachten wir die Teilchenebene. Beim Sublimieren nimmt der Stoff Sublimationswärme auf, die durch Schmelzwärme und Verdampfungswärme entsteht. Durch die Wärmezufuhr bewegen sich die Teilchen schneller und vergrößern ihren Abstand zueinander. Dadurch löst sich die feste Form auf und einzelne Teilchen können sich im Raum ausbreiten. Bei der Resublimation wird hingegen Wärme abgegeben, wodurch sich die Teilchen langsamer bewegen und wieder näher zusammenrücken. Der Stoff ordnet sich schließlich in einer festen Form an.
Es gibt neben dem gasförmigen und festen Aggregatzustand auch noch den flüssigen Zustand, in dem die Teilchen anders angeordnet sind.
Schau dir unser Video an, um mehr über diese spannenden Eigenschaften zu erfahren!
Sublimation: Der direkte Übergang von fest zu gasförmig erklärt
Was ist Sublimation?
Die Sublimation bezeichnet den direkten Übergang eines Stoffes vom festen in den gasförmigen Aggregatzustand. Anders als bei der üblichen Umwandlung von fest zu flüssig und dann zu gasförmig, wird hier der flüssige Zustand übersprungen. Bei Temperaturen unterhalb der Schmelztemperatur kann ein Stoff sublimieren, vorausgesetzt es wird Wärme zugeführt. Ein bekanntes Beispiel dafür ist die Sublimation von Wasser im Winter, wenn Schnee direkt in Wasserdampf übergeht.
Der Vorgang der Sublimation
Um die Sublimation besser zu verstehen, betrachten wir die Teilchenebene. Beim Sublimieren nimmt der Stoff Sublimationswärme auf, welche durch die Schmelzwärme und Verdampfungswärme entsteht. Durch die Zufuhr von Wärme bewegen sich die Teilchen schneller und vergrößern ihren Abstand zueinander. Die feste Form des Stoffes löst sich auf und einzelne Teilchen können sich im Raum beliebig ausbreiten. Dadurch gelangt der Stoff in den gasförmigen Zustand und sublimiert.
Beispiel: Sublimation von Iod
Ein bekanntes Beispiel für Sublimation ist die Resublimation und Sublimation von Iod. Wenn festes Iod erhitzt wird, bildet sich violettes Gas aus (Iod-Sublimation). Beim Abkühlen des Gefäßes entstehen violette bis schwarze Kristalle (Sublimat), da das gasförmige Iod direkt in feste Kristalle übergeht. Hier wird der flüssige Zustand übersprungen und die Teilchen ordnen sich in einer festen Form an. Iod gehört zu den Halogenen.
Diese Erklärung soll dir einen Überblick über die Sublimation geben und verdeutlichen, wie der direkte Übergang von fest zu gasförmig abläuft.
Sublimieren und Resublimieren: Wie ändert sich der Aggregatzustand eines Stoffes?
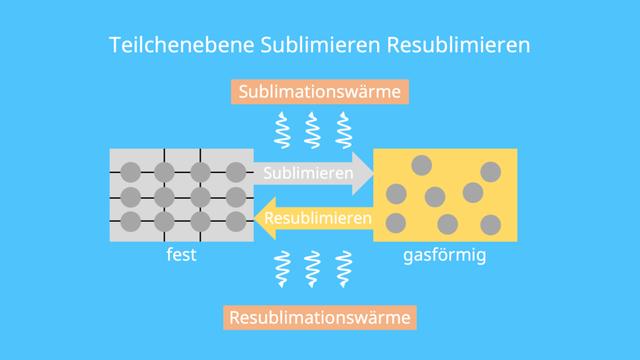
Was ist Sublimation?
Bei der Sublimation handelt es sich um den direkten Übergang eines Stoffes vom festen in den gasförmigen Aggregatzustand. Dies geschieht bereits bei Temperaturen unterhalb der Schmelztemperatur des Stoffes. Um diesen Vorgang zu ermöglichen, wird Wärme benötigt. Ein bekanntes Beispiel für Sublimation ist die Umwandlung von Schnee in Wasserdampf im Winter. Der Schnee überspringt dabei den flüssigen Zustand und wandelt sich direkt in den gasförmigen Aggregatzustand um.
Was ist Resublimation?
Resublimation bezeichnet den Gegenprozess zur Sublimation, bei dem ein Stoff vom gasförmigen in den festen Aggregatzustand übergeht. Dabei wird Wärme freigesetzt. Die Resublimation findet bei Temperaturen oberhalb der Siedetemperatur eines Stoffes statt. Ein Beispiel hierfür ist die Bildung von Reif auf Grasflächen nach einer kalten Nacht. Der Wasserdampf resublimiert zu Eis und nimmt somit wieder einen festen Zustand an.
Wie funktionieren Sublimation und Resublimation auf Teilchenebene?
Beim Sublimieren nimmt ein Stoff Sublimationswärme auf, die durch die Schmelzwärme und Verdampfungswärme entsteht. Durch die Zufuhr von Wärme bewegen sich die Teilchen des Stoffes schneller und vergrößern ihren Abstand zueinander. Dadurch löst sich die feste Form des Stoffes auf und einzelne Teilchen können sich im Raum beliebig ausbreiten, wodurch der gasförmige Zustand erreicht wird. Bei der Resublimation hingegen wird Wärme abgegeben, wodurch sich die Teilchen langsamer bewegen und ihr Abstand zueinander wieder kleiner wird. Die Teilchen ordnen sich schließlich in einer festen Form an und der Stoff nimmt den festen Aggregatzustand an.
Zusammenfassend lässt sich sagen, dass Sublimation und Resublimation den direkten Übergang eines Stoffes vom festen in den gasförmigen bzw. vom gasförmigen in den festen Aggregatzustand beschreiben. Diese Vorgänge finden bei Temperaturen statt, die unterhalb der Schmelz- bzw. Siedetemperatur liegen. Durch die Zufuhr bzw. Abgabe von Wärme verändern sich die Bewegungen und Anordnungen der Teilchen, was zu einer Änderung des Aggregatzustandes führt.
Die Bedeutung von Sublimation und Resublimation in der Physikalischen Chemie
Sublimation und Resublimation: Veränderung des Aggregatzustands
Bei der Sublimation handelt es sich um einen wichtigen Vorgang in der Physikalischen Chemie, bei dem ein Stoff direkt vom festen in den gasförmigen Aggregatzustand übergeht. Dies geschieht bereits bei Temperaturen unterhalb der Schmelztemperatur des Stoffes. Durch die Zufuhr von Wärme lösen sich die Teilchen des Stoffes voneinander und können sich im Raum beliebig ausbreiten. Dadurch erreicht der Stoff den gasförmigen Zustand. Die Sublimation findet normalerweise bei Minusgraden statt, also unterhalb der Siedetemperatur eines Stoffes.
Der gegenteilige Prozess zur Sublimation ist die Resublimation. Hierbei ändert sich der Aggregatzustand eines Stoffes von gasförmig zu fest. Bei diesem Vorgang wird Wärme frei, da sich die Teilchen langsamer bewegen und sich wieder näher zueinander anordnen. Die Resublimation findet bei Temperaturen oberhalb der Siedetemperatur eines Stoffes statt.
Anwendungen von Sublimation und Resublimation
Die Sublimation und Resublimation spielen eine wichtige Rolle in verschiedenen Bereichen der Physikalischen Chemie. Ein bekanntes Beispiel ist die Sublimation von Wasser im Winter, wo Schnee direkt in Wasserdampf übergeht und umgekehrt. Dieser Vorgang ermöglicht es, dass der Schnee auch bei kalten Temperaturen langsam verschwindet, ohne zu schmelzen.
Auch in der Forschung und Industrie werden Sublimation und Resublimation häufig genutzt. Zum Beispiel wird die Sublimation von Iod zur Gewinnung von reinem Iod verwendet. Durch Erhitzen des festen Iods entsteht violettes Gas, das direkt in feste Kristalle resublimiert, wenn es abgekühlt wird.
Die Bedeutung auf Teilchenebene
Auf Teilchenebene bedeutet die Sublimation, dass sich die Teilchen eines Stoffes durch die Zufuhr von Wärme voneinander lösen und im Raum verteilen. Dadurch erreicht der Stoff den gasförmigen Zustand. Bei der Resublimation ordnen sich die Teilchen wieder näher zueinander an und bilden eine feste Struktur. Die Sublimations- und Resublimationswärme spielen dabei eine wichtige Rolle, da sie den Übergang zwischen den Aggregatzuständen ermöglichen.
Insgesamt sind Sublimation und Resublimation wichtige Phänomene in der Physikalischen Chemie, die sowohl theoretisch als auch praktisch untersucht werden. Sie ermöglichen den direkten Übergang zwischen festem und gasförmigem Zustand eines Stoffes und finden Anwendung in verschiedenen Bereichen wie der Materialgewinnung oder Umwandlung von Schnee zu Wasserdampf.
Sublimation von Wasser: Ein genauer Blick auf den Vorgang im Winter
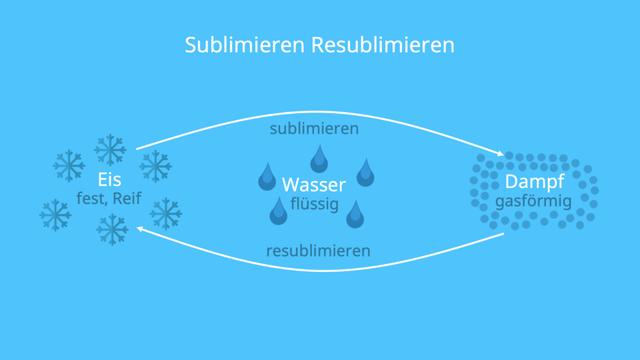
Was passiert bei der Sublimation von Wasser?
Bei kaltem Wetter im Winter kannst du beobachten, dass die Schneemenge in deinem Garten trotz der niedrigen Temperaturen abnimmt. Dies liegt daran, dass eine Sublimation stattfindet. Der Schnee überspringt den Schmelzvorgang und wandelt sich direkt in Wasserdampf um. Dabei geht der feste Aggregatzustand des Wassers in den gasförmigen über. Die Sublimation von Wasser findet bereits bei Temperaturen unter dem Schmelzpunkt von 0°C statt.
Resublimation: Der Gegenprozess zur Sublimation
Der gegenteilige Prozess zur Sublimation wird als Resublimation bezeichnet. Hierbei wechselt der Wasserdampf zurück in einen festen Zustand und bildet Reif. Nach einer kalten Nacht kannst du diesen Reif oft auf der Wiese sehen. Bei der Resublimation ändert das Wasser seinen Aggregatzustand direkt von gasförmig zu fest, ohne den flüssigen Zustand zu durchlaufen.
Beispiele für Sublimation und Resublimation
Ein bekanntes Beispiel für die Sublimation ist die Verwandlung von festem Iod in gasförmiges Iod beim Erhitzen. Das feste Iod überspringt dabei den flüssigen Zustand und geht direkt in den gasförmigen über. Beim Abkühlen bildet sich aus dem violetten Gas wieder fester Iod-Kristall.
Eine weitere Beobachtung von Sublimation und Resublimation kannst du im Winter bei der Bildung von Eisblumen an Fenstern machen. Hier sublimiert das Wasser in der Raumluft und bildet dann wieder Eiskristalle auf den kalten Fensterscheiben.
Die Sublimation und Resublimation sind interessante Phänomene, die uns ermöglichen, den Übergang zwischen den Aggregatzuständen eines Stoffes genauer zu verstehen.
Sublimieren vs. Schmelzen: Warum überspringt der Stoff den flüssigen Zustand?
1. Sublimation und Resublimation
Bei der Sublimation handelt es sich um den direkten Übergang eines Stoffes vom festen in den gasförmigen Aggregatzustand. Dies geschieht bereits bei Temperaturen unterhalb der Schmelztemperatur des Stoffes. Für diesen Vorgang ist Wärme notwendig. Der gegenteilige Prozess zur Sublimation wird als Resublimation bezeichnet, bei dem der Aggregatzustand eines Stoffes von gasförmig zu fest wechselt und dabei Wärme freigesetzt wird.
2. Beobachtung von Sublimation und Resublimation
Im Winter kann man oft die Sublimation bzw. Resublimation von Wasser beobachten. Der Schnee kann sich direkt in Wasserdampf umwandeln und umgekehrt, ohne den flüssigen Zustand zu durchlaufen. Ein ähnliches Phänomen tritt auch bei der Resublimation und Sublimation von Iod auf.
3. Teilchenebene und Aggregatzustände
Um das genaue Verständnis dieser Vorgänge zu erlangen, betrachten wir die Teilchenebene. Beim Sublimieren nimmt jeder Stoff die sogenannte Sublimationswärme auf, wodurch sich die Teilchen schneller bewegen und ihren Abstand zueinander vergrößern. Dadurch löst sich die feste Form des Stoffes auf, und einzelne Teilchen können sich im Raum beliebig ausbreiten. Beim Resublimieren hingegen wird Wärme abgegeben, wodurch sich die Teilchen langsamer bewegen und ihren Abstand zueinander wieder verringern. Sie ordnen sich schließlich in einer festen Form an.
Zusammenfassend kann gesagt werden, dass beim Sublimieren und Resublimieren der flüssige Aggregatzustand übersprungen wird. Dies ermöglicht den direkten Übergang vom festen zum gasförmigen bzw. vom gasförmigen zum festen Zustand eines Stoffes.
Sublimieren ist ein physikalischer Prozess, bei dem ein Stoff direkt vom festen in den gasförmigen Zustand übergeht, ohne den flüssigen Zustand zu durchlaufen. Durch Sublimation können reine und kristalline Substanzen gewonnen werden. Dieser Vorgang findet in verschiedenen Bereichen wie der Chemie und Lebensmittelindustrie Anwendung und ermöglicht die Trennung von Gemischen sowie die Herstellung von Duftstoffen oder gefriergetrockneten Lebensmitteln.

