Eine Ionenbindung ist eine chemische Bindung zwischen positiv und negativ geladenen Teilchen, den Ionen. Sie entsteht durch den Elektronentransfer zwischen den beteiligten Atomen. Diese Art der Bindung ist für die Stabilität von Salzen und vielen anderen Verbindungen verantwortlich.
Eine Ionenbindung: Was sie ist und wie sie entsteht
Definition einer Ionenbindung
Eine Ionenbindung, auch ionische Bindung oder elektrovalente Bindung genannt, ist eine chemische Bindungsart. Sie entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Die Elektronegativitätsdifferenz zwischen den beteiligten Partnern ist dabei sehr hoch, mit einer Richtwert von größer als 1,7.
Entstehung einer Ionenbindung
Eine Ionenbindung tritt zwischen einem Metall (wie Natrium oder Magnesium) und einem Nichtmetall (wie Sauerstoff oder Stickstoff) auf. Das Metall übergibt dabei ein oder mehrere Elektronen an das Nichtmetall, um die Edelgaskonfiguration zu erreichen. Die starke elektrostatische Anziehung zwischen den Partnern ist die treibende Kraft für die Bildung der Ionenbindung.
Eigenschaften von Ionenbindungen
– Eine Ionenbindung entsteht nur, wenn die Elektronegativitätsdifferenz größer als 1,7 ist.
– Es handelt sich um eine chemische Bindung zwischen einem Metall und einem Nichtmetall.
– Die Atome streben nach der stabilen Edelgaskonfiguration mit acht Elektronen auf der Außenschale.
– Bei der Bildung einer Ionenbindung entsteht ein Ionengitter.
– Salze mit einer Ionenbindung können elektrischen Strom leiten.
Diese Eigenschaften unterscheiden die Ionenbindung von anderen chemischen Bindungsarten wie der kovalenten Bindung und der metallischen Bindung.
Ionenbindung erklärt: Definition und Entstehung
Die Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindungsart, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Sie entsteht, wenn die Elektronegativitätsdifferenz zwischen den beteiligten Partnern sehr hoch ist. Eine EN-Differenz von größer als 1,7 gilt als Richtwert für eine Ionenbindung. Diese tritt in der Regel zwischen einem Metall wie Natrium oder Magnesium und einem Nichtmetall wie Sauerstoff oder Stickstoff auf.
Bei der Ionenbindung übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, sodass beide Partner die Edelgaskonfiguration erreichen. Die starke elektrostatische Anziehung zwischen den Partnern ist dabei die treibende Kraft. Eine Ionenbindung wird auch heteropolare Bindung genannt, da ein positives und ein negatives Ion eine Bindung eingehen.
Die Elektronenkonfiguration spielt bei der Bildung einer ionischen Bindung eine wichtige Rolle. Atome streben danach, die stabile Edelgaskonfiguration mit acht Elektronen auf der Außenschale zu erreichen. Die Hauptgruppennummer im Periodensystem gibt Auskunft über die Anzahl der Valenzelektronen eines Elements. Beachtet werden muss jedoch, dass eine Ionenbindung nur entsteht, wenn die Elektronegativitätsdifferenz größer als 1,7 ist und es sich um ein Metall und ein Nichtmetall handelt.
Ionen bilden in einer ionischen Verbindung ein räumlich regelmäßiges Ionengitter. Dieses Gitter wird durch ungerichtete ionische Bindungen stabilisiert. Die Anordnung zum Ionengitter erfolgt unter Freisetzung von Gitterenergie, die den Atomen zu einem energetisch günstigen Zustand verhilft. Bei der Zerlegung des Gitters wird genau der Betrag an Gitterenergie benötigt, um das Gitter aufzubrechen. Die Gitterenergie setzt sich aus verschiedenen Bestandteilen zusammen.
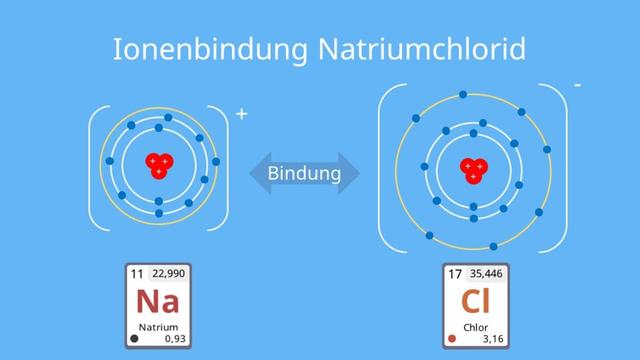
Ein Beispiel für eine Ionenbindung ist Kochsalz (Natriumchlorid). Hier übergibt Natrium sein Außenelektron an Chlor, um die Edelgaskonfiguration zu erreichen. Auch bei anderen Verbindungen wie Kaliumchlorid und Magnesiumchlorid entsteht eine Ionenbindung zwischen Metall- und Nichtmetallionen.
Ionenkristalle sind meist farblos und verhältnismäßig stabil, weshalb sie hohe Schmelz- und Siedepunkte haben. Sie sind hart und spröde, da sie bei Verformungsversuchen zerbrechen würden.
Die Ionenbindung unterscheidet sich von anderen chemischen Bindungsarten wie der kovalenten Bindung, bei der sich die Partner Elektronen teilen, oder der metallischen Bindung, bei der mehrere Atome Elektronen gemeinsam nutzen. Es gibt auch schwächere zwischenmolekulare Wechselwirkungen zwischen Molekülen.
Salzlösungen können elektrischen Strom leiten, während feste Kristalle diese Eigenschaft nicht aufweisen. Dies liegt daran, dass in Lösung frei bewegliche Ionen den Strom leiten können. Die Leitfähigkeit variiert jedoch je nach Löslichkeit des Salzes in Wasser.
Für weitere Informationen zu den zwischenmolekularen Kräften empfehlen wir unser extra Video dazu.
Grundlagen der Ionenbindung: Erklärung und Beispiele
Die Ionenbindung ist eine chemische Bindungsart, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Diese Bindung entsteht, wenn die Elektronegativitätsdifferenz zwischen den beteiligten Partnern sehr hoch ist, in der Regel größer als 1,7. Eine Ionenbindung tritt zwischen einem Metall und einem Nichtmetall auf, zum Beispiel zwischen Natrium (Na) und Sauerstoff (O). Dabei übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, um die Edelgaskonfiguration zu erreichen.
Die Elektronenkonfiguration spielt eine wichtige Rolle bei der Bildung einer ionischen Bindung. Atome streben immer danach, die stabile Edelgaskonfiguration mit acht Elektronen auf der Außenschale zu erreichen. Die Anzahl der Valenzelektronen kann durch die Hauptgruppennummer im Periodensystem bestimmt werden. Eine Ionenbindung entsteht nur, wenn die Elektronegativitätsdifferenz größer als 1,7 ist und es sich um ein Metall und ein Nichtmetall handelt.
Bei einer ionischen Verbindung bildet sich ein Ionengitter aus, bei dem die Ionen räumlich regelmäßig angeordnet sind. Dieses Gitter wird durch ungerichtete ionische Bindungen stabilisiert. Die Stabilität des Ionengitters wird durch die Gitterenergie bestimmt. Bei der Zerlegung des Gitters wird genau diese Energie benötigt.
Ein Beispiel für eine ionische Verbindung ist Kochsalz, bestehend aus Natriumchlorid (NaCl). Natrium gibt sein Außenelektron an Chlor ab, um die Edelgaskonfiguration zu erreichen. Ähnliche Ionenbindungen können auch bei anderen Verbindungen wie Kaliumchlorid (KCl) oder Magnesiumchlorid (MgCl2) beobachtet werden.
Ionenkristalle sind meist farblos und haben hohe Schmelz- und Siedepunkte aufgrund ihrer stabilen Struktur. Sie sind hart und spröde, da sie bei Verformungsversuchen zerbrechen würden. In Lösung können Salze elektrischen Strom leiten, jedoch nicht in festem Zustand.
Die Ionenbindung unterscheidet sich von anderen chemischen Bindungsarten wie der kovalenten Bindung, bei der sich die Elektronen zwischen den Atomen geteilt werden, oder der metallischen Bindung, bei der mehrere Atome die Elektronen gemeinsam nutzen. Zwischenmolekulare Wechselwirkungen sind schwächere Kräfte zwischen Molekülen.
Zusammenfassend kann gesagt werden, dass die Ionenbindung eine starke chemische Bindung zwischen einem Metall und einem Nichtmetall ist, bei der positive und negative Ionen elektrostatisch angezogen werden. Sie entsteht durch den Transfer von Elektronen und bildet ein stabiles Ionengitter.
Die Ionenbindung: Aufbau, Eigenschaften und Bedeutung
Was ist eine Ionenbindung?
Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung genannt) entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Sie tritt auf, wenn die Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern größer als 1,7 ist. Eine Ionenbindung kommt vor allem zwischen einem Metall und einem Nichtmetall zustande.
Wie entsteht eine Ionenbindung?
Bei einer Ionenbindung gibt das Metall ein oder mehrere Elektronen an das Nichtmetall ab, um beide Partner in eine stabile Edelgaskonfiguration zu bringen. Das Metall wird dabei zum positiven Ion (Kation), während das Nichtmetall zum negativen Ion (Anion) wird. Diese entgegengesetzten Ladungen ziehen sich elektrostatisch an und bilden ein Ionengitter.
Eigenschaften der Ionenbindung
– Die Ionenbindung ist sehr stark, aber nicht unbedingt stärker als viele kovalente Bindungen.
– Sie entsteht bei einer Elektronegativitätsdifferenz größer als 1,7.
– Die Atome streben danach, die stabile Edelgaskonfiguration mit acht Elektronen auf der Außenschale zu erreichen.
– Das Ionengitter besteht aus räumlich regelmäßig angeordneten Ionen.
– Die Gitterenergie spielt eine wichtige Rolle bei der Stabilität des Ionengitters.
– Ionenkristalle sind meist farblos, hart und spröde.
Die Ionenbindung ist eine bedeutende chemische Bindungsart, die in vielen Verbindungen vorkommt. Sie ermöglicht es den beteiligten Atomen, eine energetisch günstige Konfiguration zu erreichen und stabilisiert das entstehende Ionengitter.
Ionenbindung verstehen: Grundlagen und Anwendungen
Grundlagen der Ionenbindung
Die Ionenbindung, auch ionische Bindung oder elektrovalente Bindung genannt, entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Eine hohe Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Elementen ist dabei charakteristisch für eine Ionenbindung. In der Regel tritt eine Ionenbindung zwischen einem Metall und einem Nichtmetall auf, wobei das Metall ein oder mehrere Elektronen an das Nichtmetall abgibt, um eine vollbesetzte Außenschale zu erreichen.
Anwendungen der Ionenbindung
Die Ionenbindung hat zahlreiche Anwendungen in verschiedenen Bereichen. Ein bekanntes Beispiel ist die Verwendung von Salzen wie Natriumchlorid (Kochsalz) in der Lebensmittelindustrie und zum Würzen von Speisen. Salze sind auch wichtig in der Medizin, beispielsweise als Bestandteil von Infusionslösungen zur Flüssigkeits- und Elektrolytzufuhr.
Darüber hinaus spielen Ionenbindungen eine entscheidende Rolle in der Chemie und Materialwissenschaft. Sie sind verantwortlich für die Eigenschaften vieler anorganischer Verbindungen wie Kristalle, die aufgrund ihrer stabilen Struktur hohe Schmelz- und Siedepunkte aufweisen. Die elektrische Leitfähigkeit von Salzlösungen basiert ebenfalls auf den gelösten Ionen.
Insgesamt ist das Verständnis der Ionenbindung wichtig, um die chemischen Eigenschaften und Anwendungen von Verbindungen zu verstehen, insbesondere in den Bereichen Chemie, Materialwissenschaft und Medizin.
Ionenbindung einfach erklärt: Definition und Mechanismus
Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindungsart, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Sie entsteht, wenn die Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern sehr hoch ist. Eine EN-Differenz von größer als 1,7 gilt als Richtwert für eine Ionenbindung.
Bei einer Ionenbindung handelt es sich um eine chemische Bindung zwischen einem Metall und einem Nichtmetall. Typischerweise tritt sie zwischen Elementen auf, die links im Periodensystem stehen (Metalle) und Elementen, die rechts stehen (Nichtmetalle). Das Metall gibt dabei ein oder mehrere Elektronen an das Nichtmetall ab, sodass beide Partner die Edelgaskonfiguration erreichen.
Die Elektronenkonfiguration spielt bei der Bildung einer ionischen Bindung eine wichtige Rolle. Atome streben immer danach, die stabile Edelgaskonfiguration zu erreichen, also acht Elektronen auf der Außenschale zu haben. Die Anzahl der Elektronen auf der Außenschale kannst du anhand der Hauptgruppennummer im Periodensystem bestimmen.
Es ist wichtig zu beachten, dass eine Ionenbindung nur entsteht, wenn die Elektronegativitätsdifferenz größer als 1,7 ist und es sich um ein Metall-Nichtmetall-Paar handelt. Bei geringeren EN-Differenzen spricht man von einer kovalenten Bindung.
Bei einer Ionenbindung bildet sich ein Ionengitter, bei dem die Ionen eine räumlich regelmäßige Anordnung bilden. Das Gitter wird durch ungerichtete ionische Bindungen stabilisiert. Die Ionenbindung ist stark, jedoch nicht unbedingt stärker als viele kovalente Bindungen.
Ionenkristalle, die aus einer Ionenbindung bestehen, sind meist farblos und haben hohe Schmelz- und Siedepunkte. Sie sind generell hart und spröde aufgrund der starken Bindung der Valenzelektronen.
Zusammenfassend ist eine Ionenbindung eine Art chemischer Bindung, bei der positive und negative Ionen aufgrund elektrostatischer Anziehungskräfte zusammengehalten werden. Diese Bindung entsteht durch den Transfer von Elektronen zwischen Atomen. Ionenbindungen sind in vielen Salzen und Mineralien zu finden und spielen eine wichtige Rolle in der Chemie.

