Eine Ionenbindung ist eine Art chemischer Bindung, bei der positiv geladene Ionen mit negativ geladenen Ionen interagieren. Sie entsteht durch den Transfer von Elektronen zwischen den beteiligten Atomen. Die Ionenbindung ist für die Stabilität vieler Verbindungen verantwortlich und spielt eine wichtige Rolle in der Chemie.
- Leckere Honig Bonbons einfach selbst machen!
- Wie erkennt man eine Gürtelrose im Anfangsstadium?
- Lachs: Das giftigste Lebensmittel der Welt? Neue Erkenntnisse enthüllen schockierende Wahrheiten
- Einfache und gesunde Rezepte für selbst gemachte Hundeleckerlies
- Shellac-Nägel: Die perfekte Alternative für zu Hause
Erklärung der Ionenbindung: Was ist eine Ionenbindung und wie entsteht sie?
Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindungsart, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Diese Bindung entsteht, wenn die Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern sehr hoch ist. Eine EN-Differenz von größer als 1,7 gilt als Richtwert für eine Ionenbindung.
Eine Ionenbindung tritt zwischen einem Metall wie Natrium oder Magnesium und einem Nichtmetall wie Sauerstoff oder Stickstoff auf. Dabei übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, sodass beide Partner die Edelgaskonfiguration erreichen. Die starke elektrostatische Anziehung zwischen den Partnern ist die treibende Kraft für die Bildung einer Ionenbindung.
Bei der Ionengitterbildung bilden die Ionen eine räumlich regelmäßige Anordnung, wodurch ein stabiles Ionengitter entsteht. Die Gitterenergie spielt dabei eine entscheidende Rolle. Salzlösungen können elektrischen Strom leiten, während feste Kristalle diese Eigenschaft nicht besitzen.
Die Ionenbindung unterscheidet sich von anderen chemischen Bindungsarten wie der kovalenten Bindung und der metallischen Bindung. Bei der kovalenten Bindung teilen sich die Partner die Elektronen, während bei der metallischen Bindung mehrere Atome die Elektronen gemeinsam nutzen. Zwischenmolekulare Wechselwirkungen sind schwächer als die klassischen Bindungsarten.
Ionenkristalle sind meist farblos, da die Valenzelektronen stark gebunden sind und nicht von sichtbarem Licht angeregt werden können. Die Kristalle sind hart und spröde.
Ionenbindung einfach erklärt: Beispiele und Eigenschaften
Was ist eine Ionenbindung?
Eine Ionenbindung, auch ionische Bindung oder elektrovalente Bindung genannt, entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Diese Bindungsart tritt auf, wenn die Elektronegativitätsdifferenz zwischen den beteiligten Partnern sehr hoch ist, in der Regel größer als 1,7. Eine Ionenbindung findet oft zwischen einem Metall wie Natrium oder Magnesium und einem Nichtmetall wie Sauerstoff oder Stickstoff statt.
Wie entsteht eine Ionenbindung?
Bei einer Ionenbindung übergibt das Metall dem Nichtmetall ein oder mehrere Elektronen, um beide Partner in eine Edelgaskonfiguration zu bringen. Das Metall gibt dabei Elektronen ab und wird zum positiven Ion (Kation), während das Nichtmetall diese Elektronen aufnimmt und zum negativen Ion (Anion) wird. Die starke elektrostatische Anziehung zwischen den beiden geladenen Partikeln führt zur Bildung einer stabilen chemischen Bindung.
Beispiele für Ionenbindungen
Ein Beispiel für eine Ionenbindung ist die Verbindung von Natrium (Na) mit Chlor (Cl) zu Kochsalz (NaCl). Natrium gibt dabei sein Außenelektron an Chlor ab, sodass Natrium zum positiven Na+-Ion wird und Chlor zum negativen Cl–Ion. Ein weiteres Beispiel ist die Verbindung von Kalium (K) mit Chlor zu Kaliumchlorid (KCl). Hier gibt Kalium ein Elektron ab und Chlor nimmt es auf, sodass sich K+ und Cl- Ionen bilden. Ähnlich verläuft die Bildung von Magnesiumchlorid (MgCl2) und Calciumchlorid (CaCl2).
Eigenschaften von Ionenbindungen
Ionenbindungen sind sehr stark, aber nicht unbedingt stärker als viele kovalente Bindungen. Sie bilden räumlich regelmäßige Anordnungen, sogenannte Ionengitter. Diese Gitter werden durch ungerichtete ionische Bindungen stabilisiert. Ionenkristalle haben meist hohe Schmelz- und Siedepunkte, da sie aufgrund ihrer stabilen Struktur eine große Menge Energie benötigen, um in den flüssigen Zustand überzugehen. Salze sind oft farblos, da ihre Valenzelektronen stark gebunden sind und nicht von sichtbarem Licht angeregt werden können. Ionenkristalle sind zudem hart und spröde.
Diese Eigenschaften machen Ionenbindungen zu wichtigen Bestandteilen vieler chemischer Verbindungen und Materialien.
Die Ionenbindung: Aufbau, Entstehung und Eigenschaften
Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung genannt) entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Sie tritt auf, wenn die Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern sehr hoch ist, in der Regel größer als 1,7. Eine Ionenbindung bildet sich zwischen einem Metall und einem Nichtmetall, zum Beispiel Natrium (Na) und Sauerstoff (O). Bei der Ionenbindung übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, um eine vollbesetzte Außenschale zu erreichen.
Der Aufbau einer Ionenbindung führt zur Bildung eines Ionengitters. Hierbei ordnen sich die Ionen räumlich regelmäßig an und werden durch ungerichtete ionische Bindungen stabilisiert. Die Atome streben immer danach, eine stabile Edelgaskonfiguration mit acht Elektronen auf der Außenschale zu erreichen.
Die Eigenschaften von Ionenbindungen sind unter anderem ihre Stärke und ihre Fähigkeit, elektrischen Strom zu leiten. Eine Ionenbindung ist stark, jedoch nicht unbedingt stärker als viele kovalente Bindungen. In festen Kristallen können sie keine elektrische Leitfähigkeit aufweisen, da die frei beweglichen Ionen in Lösung den Strom leiten können. Salze haben meist hohe Schmelz- und Siedepunkte aufgrund ihrer stabilen Struktur. Sie sind generell hart und spröde.
Zusammenfassend kann man sagen, dass eine Ionenbindung zwischen einem Metall und einem Nichtmetall entsteht, wenn die Elektronegativitätsdifferenz größer als 1,7 ist. Sie führt zur Bildung eines Ionengitters und besitzt bestimmte Eigenschaften wie Stärke und Leitfähigkeit.
Grundlagen der Ionenbindung: Definition und Merkmale
Eine Ionenbindung (auch ionische Bindung oder elektrovalente Bindung) ist eine chemische Bindung, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Diese Bindungsart entsteht durch eine hohe Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern. Eine EN-Differenz von größer als 1,7 gilt dabei als Richtwert für eine Ionenbindung.
Eine Ionenbindung tritt zwischen einem Metall wie Natrium oder Magnesium und einem Nichtmetall wie Sauerstoff oder Stickstoff auf. Dabei übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, sodass beide Partner die Edelgaskonfiguration mit einer vollbesetzten Außenschale erreichen.
Die Ionenbindung basiert auf der starken elektrostatischen Anziehung zwischen den Partnern. Es entstehen positive und negative Ionen, die gemeinsam ein Ionengitter bilden. Die räumlich regelmäßige Anordnung im Ionengitter wird durch ungerichtete ionische Bindungen stabilisiert.
Die Elektronenkonfiguration spielt bei der Ionenbindung eine wichtige Rolle, da Atome immer danach streben, die stabile Edelgaskonfiguration zu erreichen. Die Hauptgruppennummer im Periodensystem gibt Auskunft über die Anzahl der Elektronen auf der Außenschale (Valenzelektronen).
Es ist wichtig zu beachten, dass die Ionenbindung nur entsteht, wenn die Elektronegativitätsdifferenz größer als 1,7 ist und es sich um ein Metall und ein Nichtmetall handelt. Bei einer Elektronegativitätsdifferenz von weniger als 1,7 liegt eine kovalente Bindung vor.
Die Ionenbindung ist eine starke Bindungsart, aber nicht unbedingt stärker als viele kovalente Bindungen. Sie ist charakterisiert durch hohe Schmelz- und Siedepunkte sowie die Bildung farbloser, harter und spröder Ionenkristalle.
Zusammenfassend kann gesagt werden, dass die Ionenbindung eine chemische Bindung zwischen einem Metall und einem Nichtmetall ist, bei der positive und negative Ionen elektrostatisch angezogen werden. Sie entsteht durch eine hohe Elektronegativitätsdifferenz und basiert auf der Anstrengung der Atome, die Edelgaskonfiguration zu erreichen.
Alles über die Ionenbindung: Entstehung, Partnerwahl und Eigenschaften
Was ist eine Ionenbindung?
Eine Ionenbindung, auch ionische Bindung oder elektrovalente Bindung genannt, entsteht durch die elektrostatische Anziehung zwischen positiv und negativ geladenen Ionen. Diese Bindungsart tritt auf, wenn die Elektronegativitätsdifferenz (ΔEN) zwischen den beteiligten Partnern größer als 1,7 ist. In der Regel bildet sich eine Ionenbindung zwischen einem Metall und einem Nichtmetall.
Entstehung einer Ionenbindung
Bei einer Ionenbindung übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, um beide Partner in eine stabile Edelgaskonfiguration zu bringen. Das Metall gibt dabei seine Elektronen ab und wird dadurch zum positiv geladenen Ion (Kation), während das Nichtmetall die Elektronen aufnimmt und zum negativ geladenen Ion (Anion) wird.
Eigenschaften der Ionenbindung
Die Ionenbindung basiert auf der starken elektrostatischen Anziehung zwischen den Partnern und ist daher eine sehr starke Bindungsart. Die Bildung eines Ionengitters führt zu einer räumlich regelmäßigen Anordnung der Ionen. Salze mit einer Ionenbindung sind meist farblos, haben hohe Schmelz- und Siedepunkte sowie eine hohe Stabilität. Sie sind hart und spröde.
Zusammenfassend kann man sagen, dass die Ionenbindung eine chemische Bindung zwischen einem Metall und einem Nichtmetall ist, bei der Elektronen übertragen werden, um eine stabile Edelgaskonfiguration zu erreichen. Die starke elektrostatische Anziehung zwischen den entgegengesetzt geladenen Ionen führt zur Bildung eines Ionengitters. Salze mit einer Ionenbindung sind meist farblos, hart und spröde.
Verständliche Erklärung der Ionenbindung mit Beispielen
Die Ionenbindung ist eine chemische Bindungsart, bei der sich positive und negativ geladene Ionen elektrostatisch anziehen. Sie entsteht, wenn die Elektronegativitätsdifferenz zwischen den beteiligten Partnern sehr hoch ist, in der Regel größer als 1,7. Eine Ionenbindung tritt typischerweise zwischen einem Metall und einem Nichtmetall auf. Dabei übergibt das Metall ein oder mehrere Elektronen an das Nichtmetall, um beide Partner zur Edelgaskonfiguration zu bringen.
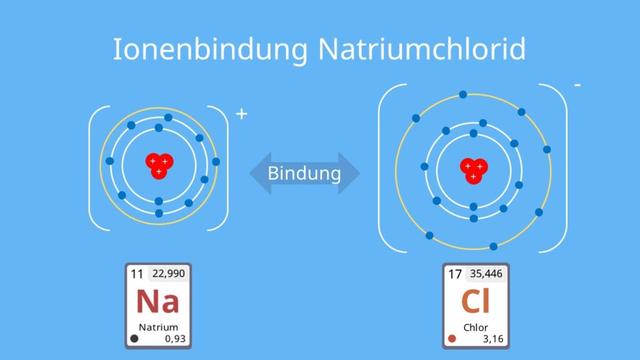
Ein Beispiel für eine Ionenbindung ist Natriumchlorid (NaCl). Natrium (Na) ist ein Metall und Chlor (Cl) ein Nichtmetall. Die Elektronegativitätsdifferenz zwischen Natrium und Chlor beträgt 2,55 – 0,93 = 1,62. Da diese Differenz größer als 1,7 ist, entsteht eine Ionenbindung. Natrium gibt sein Außenelektron an Chlor ab und bildet das positiv geladene Natriumion (Na+) und das negativ geladene Chloridion (Cl-).
Ein weiteres Beispiel für eine Ionenbindung ist Kaliumchlorid (KCl). Hier gibt Kalium sein Außenelektron an Chlor ab und es entstehen das positiv geladene Kaliumion (K+) und zwei negativ geladene Chloridionen (Cl-).
Ionenbindungen führen zur Bildung von Ionengittern, bei denen die Ionen räumlich regelmäßig angeordnet sind. Diese Gitter werden durch ungerichtete ionische Bindungen stabilisiert. Ionenbindungen sind stark, jedoch nicht unbedingt stärker als kovalente Bindungen. Sie haben hohe Schmelz- und Siedepunkte und sind meist farblos, da die Valenzelektronen stark gebunden sind und nicht von sichtbarem Licht angeregt werden können.
Zusammenfassend kann man sagen, dass eine Ionenbindung zwischen einem Metall und einem Nichtmetall entsteht, wenn die Elektronegativitätsdifferenz größer als 1,7 ist. Dabei gibt das Metall ein oder mehrere Elektronen an das Nichtmetall ab, um die Edelgaskonfiguration zu erreichen. Die entstehenden Ionen bilden räumlich regelmäßige Ionengitter.
Zusammenfassend lässt sich sagen, dass eine Ionenbindung eine Art chemischer Bindung ist, bei der positiv geladene Ionen (Kationen) und negativ geladene Ionen (Anionen) durch elektrostatische Kräfte angezogen werden. Diese Bindung entsteht zwischen Metallen und Nichtmetallen und führt zur Bildung von ionischen Verbindungen. Sie ist gekennzeichnet durch hohe Schmelz- und Siedepunkte sowie gute elektrische Leitfähigkeit in geschmolzenem oder gelöstem Zustand. Die Ionenbindung trägt wesentlich zur Stabilität vieler Salze und Mineralien bei.

