Valenzelektronen sind die Elektronen in der äußersten Schale eines Atoms, die für chemische Reaktionen verantwortlich sind. Sie bestimmen die chemischen Eigenschaften eines Elements und beeinflussen seine Fähigkeit, Bindungen mit anderen Atomen einzugehen. Die Anzahl der Valenzelektronen kann Aufschluss über das Verhalten eines Elements geben und ist daher von großer Bedeutung in der Chemie.
- Schöne Weihnachtswichtel aus Tanne und Moos selber basteln
- Wann läuft das große Finale von DSDS 2023? Informationen zur Ausstrahlung!
- Hacks zur Selbst-Haarspitzenpflege: Einfache Anleitung für gesunde Spitzen
- Dschungel Kostüm selber machen: Kreative und einfache Ideen für Fasching
- Leckere und schnelle Bratensoße selbst gemacht – Rezept mit Bilder
Die Bedeutung von Valenzelektronen in der Chemie
Valenzelektronen sind Elektronen, die sich in der äußersten Schale eines Atoms befinden. Sie spielen eine entscheidende Rolle in der Chemie, da sie bestimmen, wie ein Atom mit anderen Atomen reagiert und welche chemischen Verbindungen es bilden kann. Die Anzahl der Valenzelektronen eines Atoms bestimmt seine Valenz, also die Fähigkeit, Bindungen mit anderen Atomen einzugehen.
Die Bedeutung von Valenzelektronen für die Reaktivität
Die Anzahl der Valenzelektronen beeinflusst maßgeblich die Reaktivität eines Elements. Elemente mit einer vollen oder fast vollen Außenschale (8 Elektronen) sind tendenziell stabil und reaktionsarm. Diese Elemente gehören zu den Edelgasen, da sie bereits eine stabile Elektronenkonfiguration besitzen. Aufgrund ihrer geringeren Reaktivität werden Edelgase oft als Inertgase bezeichnet.
Auf der anderen Seite haben Elemente mit wenigen Valenzelektronen eine höhere Reaktivität, da sie dazu neigen, Elektronen aufzunehmen oder abzugeben, um eine stabile Konfiguration zu erreichen. Diese Elemente sind bekannt als Hauptgruppenelemente und können sowohl Metalle als auch Nichtmetalle sein. Ihre Fähigkeit zur Bildung von Bindungen ermöglicht es ihnen, verschiedene Verbindungen einzugehen und chemische Reaktionen einzugehen.
Die Bedeutung von Valenzelektronen für die Periodizität
Die Anordnung der Elemente im Periodensystem basiert auf der Anzahl der Valenzelektronen. Die Periodizität, also die regelmäßige Wiederholung von Eigenschaften entlang einer Periode oder Gruppe, ist eng mit den Valenzelektronen verbunden. Elemente in derselben Gruppe haben ähnliche chemische Eigenschaften, da sie die gleiche Anzahl an Valenzelektronen besitzen und daher ähnlich reagieren.
Die Valenzelektronen bestimmen auch die elektrische Leitfähigkeit von Materialien. Metalle haben wenige Valenzelektronen und können diese leicht bewegen, wodurch sie gute Leiter für Elektrizität und Wärme sind. Nichtmetalle hingegen haben viele Valenzelektronen und können diese nicht so einfach bewegen, wodurch sie eher Isolatoren sind.
Insgesamt sind Valenzelektronen entscheidend für das Verständnis der chemischen Eigenschaften von Elementen und ihrer Fähigkeit zur Bildung von Verbindungen. Durch das Studium der Valenzelektronen können Chemiker Vorhersagen über Reaktivität, Bindungsarten und andere wichtige Aspekte chemischer Reaktionen treffen.
Eine Einführung in das Konzept der Valenzelektronen
Die Valenzelektronen sind die Elektronen, die sich in der äußersten Schale eines Atoms befinden. Sie spielen eine wichtige Rolle bei chemischen Reaktionen und der Bildung von Molekülen. Die Anzahl der Valenzelektronen bestimmt die chemischen Eigenschaften eines Elements und beeinflusst, wie es mit anderen Elementen reagiert.
Eine Möglichkeit, die Anzahl der Valenzelektronen zu bestimmen, ist die Betrachtung des Periodensystems der Elemente. Die Hauptgruppen des Periodensystems geben an, wie viele Valenzelektronen ein Element hat. Zum Beispiel haben alle Elemente in Gruppe 1 (Alkalimetalle) ein Valenzelektron, während die Elemente in Gruppe 18 (Edelgase) acht Valenzelektronen haben. Diese Regel wird als Oktettregel bezeichnet und besagt, dass Atome dazu neigen, acht Valenzelektronen zu erreichen, um stabiler zu sein.
Valenzelektronen sind für chemische Bindungen von großer Bedeutung. Wenn zwei oder mehr Atome miteinander reagieren, können sie ihre Valenzelektronen teilen oder übertragen, um stabile Verbindungen zu bilden. Dieser Prozess wird als chemische Bindung bezeichnet. Die Anzahl der verfügbaren Valenzelektronen bestimmt auch die Art der chemischen Bindung – ob es sich um eine kovalente Bindung handelt, bei der Elektronen geteilt werden, oder um eine ionische Bindung, bei der Elektronen übertragen werden.
Insgesamt sind Valenzelektronen entscheidend für das Verständnis der chemischen Eigenschaften von Elementen und die Bildung von Verbindungen. Sie bestimmen, wie Atome miteinander reagieren und welche Art von Bindungen sie bilden können. Das Konzept der Valenzelektronen ist daher ein grundlegendes Konzept in der Chemie und hilft uns, die Vielfalt der chemischen Reaktionen und Verbindungen in unserer Welt zu verstehen.
Valenzelektronen: Ihre Rolle in chemischen Reaktionen
Valenzelektronen spielen eine entscheidende Rolle in chemischen Reaktionen. Sie sind die Elektronen, die sich in der äußersten Schale eines Atoms befinden und somit für die chemischen Eigenschaften des Elements verantwortlich sind. Diese Elektronen können entweder geteilt, übertragen oder zwischen den Atomen ausgetauscht werden, um neue Verbindungen zu bilden.
Elektronenübertragung:
In einigen chemischen Reaktionen werden Valenzelektronen von einem Atom auf ein anderes übertragen. Dies geschieht oft zwischen Metallen und Nichtmetallen. Wenn ein Metallatom Valenzelektronen an ein Nichtmetallatom abgibt, wird es positiv geladen, da es nun weniger Elektronen hat als Protonen im Kern. Das Nichtmetallatom nimmt diese Elektronen auf und wird negativ geladen. Durch diese Übertragung entstehen Ionen, die durch elektrostatische Anziehungskräfte zusammengehalten werden.
Elektronenteilung:
In anderen Fällen teilen sich zwei Atome Valenzelektronen, um eine gemeinsame Bindung einzugehen. Dies tritt oft bei nichtmetallischen Elementen auf. Die gemeinsamen Elektronen werden als Bindungselektronen bezeichnet und halten die beiden Atome zusammen. Je nach Anzahl der gemeinsamen Elektronen kann eine Einfach-, Doppel- oder Dreifachbindung gebildet werden.
Die Anzahl der Valenzelektronen in einem Atom bestimmt auch seine Reaktivität. Elemente mit nur wenigen Valenzelektronen tendieren dazu, Elektronen zu verlieren und positive Ladungen zu bilden, während Elemente mit vielen Valenzelektronen eher Elektronen aufnehmen und negative Ladungen bilden. Diese Eigenschaften sind von großer Bedeutung für die Bildung von Verbindungen und das Verständnis chemischer Reaktionen.
Was sind Valenzelektronen und warum sind sie wichtig?
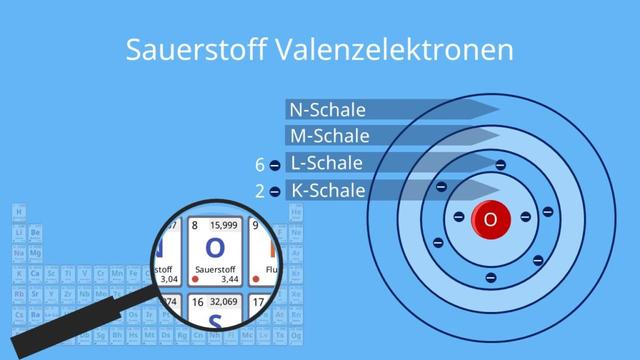
Valenzelektronen sind die Elektronen in der äußersten Schale eines Atoms. Sie bestimmen die chemischen Eigenschaften eines Elements und spielen eine wichtige Rolle bei chemischen Reaktionen. Die Anzahl der Valenzelektronen kann dazu führen, dass ein Atom stabil wird, indem es Elektronen aufnimmt oder abgibt, um eine volle äußere Schale zu erreichen.
Die Anzahl der Valenzelektronen kann uns auch Aufschluss über die Position eines Elements im Periodensystem geben. Elemente in derselben Gruppe haben oft ähnliche Eigenschaften aufgrund ihrer gleichen Anzahl an Valenzelektronen. Zum Beispiel haben alle Alkalimetalle in der ersten Gruppe des Periodensystems nur ein Valenzelektron und neigen daher dazu, dieses Elektron abzugeben, um eine stabile Konfiguration zu erreichen.
Valenzelektronen sind wichtig, weil sie den Bindungsprozess zwischen Atomen beeinflussen. Wenn zwei Atome miteinander reagieren, können sie ihre Valenzelektronen teilen oder übertragen, um eine stabile Verbindung einzugehen. Dieser Prozess bildet die Grundlage für die Bildung von Molekülen und ermöglicht es uns, verschiedene Verbindungen mit unterschiedlichen Eigenschaften herzustellen.
Insgesamt spielen Valenzelektronen eine entscheidende Rolle in der Chemie, da sie die Reaktivität und Bindungsfähigkeit von Elementen bestimmen. Das Verständnis der Anzahl und Verteilung von Valenzelektronen ist daher von großer Bedeutung, um die chemischen Eigenschaften und Verhaltensweisen von Elementen zu verstehen.
Die Eigenschaften und Funktionen von Valenzelektronen
Valenzelektronen sind die Elektronen, die sich in der äußersten Schale eines Atoms befinden. Sie haben eine besondere Bedeutung für die chemischen Eigenschaften eines Elements, da sie maßgeblich an chemischen Reaktionen beteiligt sind. Die Anzahl der Valenzelektronen bestimmt die Reaktivität eines Elements und seine Fähigkeit, Bindungen mit anderen Atomen einzugehen.
Eine wichtige Eigenschaft von Valenzelektronen ist ihre Energie. Je weiter ein Elektron von einem Atomkern entfernt ist, desto höher ist seine Energie. Valenzelektronen haben daher eine vergleichsweise hohe Energie im Vergleich zu den Elektronen in den inneren Schalen des Atoms. Diese höhere Energie ermöglicht es ihnen, leichter an chemischen Reaktionen teilzunehmen und Bindungen mit anderen Atomen einzugehen.
Die Funktion von Valenzelektronen besteht darin, Bindungen zwischen Atomen zu bilden. Dies geschieht durch das Teilen oder Übertragen von Elektronen zwischen den beteiligten Atomen. Durch die Bildung von Bindungen können Atome eine stabile elektronische Konfiguration erreichen und somit energetisch günstiger werden. Die Art der Bindung, die ein Atom eingehen kann, hängt von der Anzahl seiner Valenzelektronen ab. Ein Element mit wenigen Valenzelektronen tendiert dazu, Elektronen zu verlieren und positive Ionen zu bilden (Kation), während ein Element mit vielen Valenzelektronen eher dazu neigt, Elektronen aufzunehmen und negative Ionen zu bilden (Anion).
Zusammenfassend sind Valenzelektronen die Elektronen in der äußersten Schale eines Atoms, die maßgeblich an chemischen Reaktionen und der Bildung von Bindungen beteiligt sind. Ihre hohe Energie ermöglicht es ihnen, leichter an Reaktionen teilzunehmen, während ihre Anzahl die Reaktivität eines Elements bestimmt. Durch das Teilen oder Übertragen von Valenzelektronen können Atome stabile elektronische Konfigurationen erreichen und somit energetisch günstiger werden.
Wie beeinflussen Valenzelektronen die chemische Bindung?
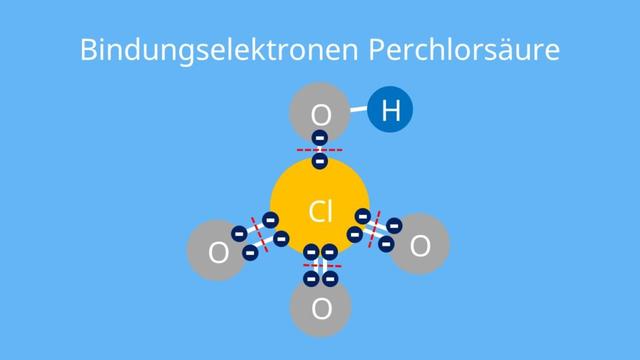
1. Elektronenverteilung und Bindungsarten
Valenzelektronen sind die Elektronen, die sich in der äußersten Schale eines Atoms befinden und maßgeblich an chemischen Reaktionen beteiligt sind. Sie bestimmen die Art der chemischen Bindung, die ein Atom eingehen kann. Valenzelektronen können entweder als freie Elektronenpaare oder als bindende Elektronenpaare vorliegen.
Bei der Bildung einer chemischen Bindung teilen oder übertragen Atome ihre Valenzelektronen, um eine stabile elektronische Konfiguration zu erreichen. Dies geschieht durch Ausbildung von bindenden Elektronenpaaren zwischen den beteiligten Atomen. Je nachdem, wie viele Valenzelektronen ein Atom hat und wie viele davon für die Bildung von bindenden Elektronenpaaren zur Verfügung stehen, können verschiedene Arten von Bindungen entstehen, wie beispielsweise Ionenbindungen, kovalente Bindungen oder metallische Bindungen.
2. Stabilität und Reaktivität
Die Anzahl der Valenzelektronen eines Atoms beeinflusst auch seine Stabilität und Reaktivität. Atome streben danach, eine vollständig gefüllte äußere Schale zu haben, da dies zu einer energetisch günstigen Konfiguration führt. Wenn ein Atom nicht genügend Valenzelektronen hat, um diese stabile Konfiguration zu erreichen, wird es reaktionsfreudiger sein und versuchen, Elektronen von anderen Atomen zu gewinnen, um seine äußere Schale zu füllen. Auf der anderen Seite werden Atome mit einer fast vollen äußeren Schale eher Elektronen abgeben, um die stabile Konfiguration zu erreichen.
Die Reaktivität eines Elements wird auch durch die Anzahl der Valenzelektronen in seiner äußersten Schale bestimmt. Elemente mit nur wenigen Valenzelektronen sind oft reaktionsfreudiger als solche mit vielen Valenzelektronen. Dies liegt daran, dass sie weniger Energie benötigen, um ihre elektronische Konfiguration zu verändern und somit leichter Bindungen eingehen können.
Zusammenfassend beeinflussen Valenzelektronen die chemische Bindung durch ihre Verteilung und ihre Anzahl. Sie bestimmen die Art der Bindung, die ein Atom eingehen kann, sowie dessen Stabilität und Reaktivität. Die Kenntnis der Valenzelektronenkonfiguration eines Elements ist daher wichtig, um sein chemisches Verhalten und seine Eigenschaften zu verstehen.
Zusammenfassend sind Valenzelektronen die Elektronen in der äußersten Schale eines Atoms, die für chemische Reaktionen und Bindungen verantwortlich sind. Sie bestimmen die chemischen Eigenschaften eines Elements und beeinflussen seine Reaktivität. Das Verständnis von Valenzelektronen ist wichtig, um das Verhalten von Elementen in chemischen Reaktionen zu verstehen.

